Селенорганическая химия - Organoselenium chemistry
Селенорганическое соединение (или селеновый-органический) являются химическими соединениями , содержащих углеродные -До- селена химических связей . Селеноорганическая химия - соответствующая наука, изучающая их свойства и реакционную способность. Селен вместе с кислородом и серой относится к элементам или халькогенам группы 16 , и следовало ожидать сходства в химии. Селенорганические соединения обнаруживаются в следовых количествах в окружающих водах, почвах и отложениях.
Селен может существовать со степенью окисления -2, +2, +4, +6. Se (II) является доминирующей формой в химии селенорганических соединений. Ниже по столбцу группы 16 сила связи становится все более слабой (234 кДж / моль для связи C-Se и 272 кДж / моль для связи C-S), а длина связи увеличивается (C-Se 198 пм, C-S 181 pm и C − O 141 pm). Соединения селена более нуклеофильны, чем соответствующие соединения серы, а также более кислые. Значения p K a для XH 2 составляют 16 для кислорода, 7 для серы и 3,8 для селена. В отличие от сульфоксидов соответствующие селеноксиды нестабильны в присутствии β-протонов, и это свойство используется во многих органических реакциях селена, особенно при окислении селеноксида и удалении селеноксида.
Первое Селенорганическое соединение , изолировать был диэтил селенида в 1836 году.
Структурная классификация селенорганических соединений
- Селенолы (RSeH) представляют собой селеновые эквиваленты спиртов и тиолов . Эти соединения относительно нестабильны и обычно имеют неприятный запах. Бензолезеленол (также называемый селенафенолом или PhSeH) более кислый (pK a 5,9), чем тиофенол (pK a 6,5), а также более легко окисляется до диселенида . Селенафенол получают путем восстановления дифенилдиселенида.
- Диселениды (R-Se-Se-R) представляют собой селеновые эквиваленты пероксидов и дисульфидов . Они являются полезными и стабильными при хранении предшественниками более реакционноспособных селенорганических реагентов, таких как селенолы и селанилгалогениды. Наиболее известным в органической химии является дифенилдиселенид , получаемый из бромида фенилмагния и селена с последующим окислением продукта PhSeMgBr.
- Галогениды селанила (R-Se-Cl, R-Se-Br) получают галогенированием диселенидов. Бромирование дифенилдиселенида дает фенилселанилбромид (PhSeBr). Эти соединения являются источниками «PhSe + ».
- Селениды (R-Se-R), также называемые селенэфирами , представляют собой селеновые эквиваленты простых эфиров и сульфидов . Одним из примеров является диметилселенид ((CH 3 ) 2 Se). Это наиболее распространенные селенорганические соединения. Симметричные селениды обычно получают алкилированием солей селенидов щелочных металлов, например селенида натрия . Несимметричные селениды получают алкилированием селеноатов. Эти соединения обычно реагируют как нуклеофилы , например, с алкилгалогенидами (R'-X) с образованием солей селенония R'RRSe + X - . Двухвалентный селен также может взаимодействовать с мягкими гетероатомами с образованием центров гипервалентного селена. В некоторых случаях они также реагируют как электрофилы, например с литийорганическими реагентами (R'Li), с комплексом R'RRSe - Li + .
- Селеноксиды (R-Se (O) -R) представляют собой селеновые эквиваленты сульфоксидов . Они могут быть дополнительно окислены до селенонов R-Se (O) 2 R, селеновых аналогов сульфонов .
- SeO -Selenoperoxols (RSE-OH, ранее selenenic кислоты) являются промежуточнымипри окислении selenols. Они присутствуют в некоторых селеноферментах, таких какглутатионпероксидаза.
- Селениновые кислоты (RSe (O) OH) являются аналогами сульфиновых кислот .
- Пероксиселениновые кислоты (RSe (O) OOH) катализируют реакции эпоксидирования и окисления Байера – Виллигера .
- Селенураны представляют собой гипервалентные селенорганические соединения, формально производные от тетрагалогенидов, таких как SeCl 4 . Примеры относятся к типу ArSeCl 3 . Хлориды получают хлорированием селененилхлорида .
- Селенираны представляют собой трехчленные кольца (родительский: C 2 H 4 Se), относящиеся к тииранам, но, в отличие от тииранов, селенираны кинетически нестабильны, непосредственно экструдируя селен (без окисления) с образованием алкенов . Это свойство было использовано в синтетической органической химии.
- Селоны (R 2 C = Se) являются селеновыми аналогами кетонов. Они редки из-за их склонности к олигомеризации . Диселенобензохинон стабилен как комплекс металла. Селеномочевина является примером стабильного соединения, содержащего связь C = Se.
- Селенотиопероксиды (R-Se-S-R), соединения со связями селен-сера, аналогичные дисульфидам .
Селенорганические соединения в природе
Селен в форме селенорганических соединений является важным микронутриентом, отсутствие которого в рационе вызывает дисфункцию сердечной мышцы и скелета. Селенорганические соединения необходимы для защиты клеток от окислительного повреждения и для правильного функционирования иммунной системы. Они также могут играть роль в предотвращении преждевременного старения и рака. Источником селена, используемого в биосинтезе, является селенфосфат .
Глутатионоксидаза - это фермент, в активном центре которого находится селенол. Селенорганические соединения обнаружены у высших растений. Например, при анализе чеснока с использованием методики высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией с индуктивно связанной плазмой (HPLC-ICP-MS) было обнаружено, что γ-глутамил- Se -метилселеноцистеин был основным Se-содержащим компонентом, вместе с меньшим количеством Se -метилселеноцистеина . Следы диметилселенида и аллилметилселенида обнаруживаются в дыхании человека после употребления сырого чеснока.
Селеноцистеин и селенометионин
Селеноцистеин , называемый двадцать первой аминокислотой, необходим для управляемого рибосомами синтеза белка в некоторых организмах. В настоящее время известно более 25 селенсодержащих белков (селенопротеинов). Большинство селензависимых ферментов содержат селеноцистеин , который связан с аналогом цистеина, но селен замещает серу. Эта аминокислота является закодирована особым образом с помощью ДНК.
Селенометионин - это селенидсодержащая аминокислота, которая также встречается в природе, но образуется в результате посттранскрипционной модификации.
Селенорганическая химия в органическом синтезе
Селенорганические соединения представляют собой специализированный, но полезный набор реагентов, используемых в органическом синтезе, хотя они обычно исключаются из процессов, используемых в фармацевтике, из-за проблем с нормативным регулированием. Их полезность зависит от определенных атрибутов, включая (i) слабость связи C-Se и (ii) легкое окисление соединений двухвалентного селена.
Виниловые селениды
Виниловые селениды представляют собой селенорганические соединения, которые играют роль в органическом синтезе, особенно в разработке удобных стереоселективных путей к функционализированным алкенам . Хотя для получения виниловых селенидов упоминаются различные методы, более полезная процедура сосредоточена на добавлении нуклеофильного или электрофильного селенорганического соединения к концевым или внутренним алкинам . Например, нуклеофильное присоединение селенфенола к алкинам дает, предпочтительно, Z-виниловые селениды после более длительного времени реакции при комнатной температуре. Реакция идет быстрее при высокой температуре; однако смесь Z- и E-виниловых селенидов была получена в соотношении почти 1: 1. С другой стороны, аддукты зависят от природы заместителей при тройной связи . Напротив, виниловые селениды могут быть получены катализируемым палладием гидроселенированием алкинов с получением марковниковского аддукта с хорошими выходами. Есть некоторые ограничения, связанные с методологиями получения виниловых селенидов, проиллюстрированных выше; процедуры , описанные используют diorganoyl диселениды или selenophenol в качестве исходных материалов, которые являются летучими и нестабильны и имеют неприятный запах. Кроме того, получение этих соединений сложное.
Селеноксидные окисления
Диоксид селена полезен при окислении органических веществ . В частности, SeO 2 будет превращать аллильную метиленовую группу в соответствующий спирт . Эту реакцию вызывает ряд других реагентов.
С точки зрения механизма реакции , SeO 2 и аллильный субстрат реагируют через перициклический процесс, начиная с еновой реакции, которая активирует связь C-H. Второй шаг - [2,3] сигматропная реакция . Окисление с участием диоксида селена часто проводят с каталитическими количествами соединения селена и в присутствии жертвенного катализатора или сооксиданта, такого как перекись водорода .
Окисление на основе SeO 2 иногда дает карбонильные соединения, такие как кетоны , β- пинен и окисление циклогексанона до 1,2-циклогександиона. Окисление кетонов, содержащих α-метиленовые группы, дает дикетоны. Этот тип окисления оксидом селена называется окислением Райли .
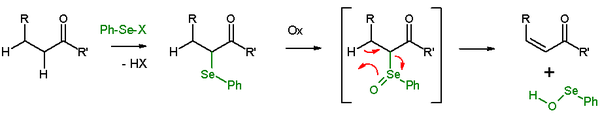
Удаление селеноксида
В присутствии бета-водорода, селенида даст реакции элиминирования после окисления, чтобы оставить позади алкена и SeO -selenoperoxol . SeO -selenoperoxol обладает высокой реакционной способностью и не выделяют в качестве таковых. В реакции элиминирования все пять участвующих реакционных центров компланарны, и, следовательно, стереохимия реакции является синонимом . Используемые окислители - перекись водорода , озон или MCPBA . Этот тип реакции часто используется с кетонами, приводящими к енонам . Примером является отщепление ацетилциклогексанона бензолселенилхлоридом и гидридом натрия .
Устранение Грико аналогичное устранение selenoxide с использованием о-nitrophenylselenocyanate и трибутилфосфина , чтобы вызвать исключение из элементов H 2 O.