Механизм реакции - Reaction mechanism
В химии , А механизм реакции является шаг за шагом последовательности из элементарных реакций , с помощью которого в целом химическое происходит изменение.
Химический механизм - это теоретическая гипотеза, которая пытается подробно описать, что происходит на каждой стадии общей химической реакции. Подробные этапы реакции в большинстве случаев не наблюдаются. Предполагаемый механизм выбран потому, что он термодинамически осуществим и имеет экспериментальное подтверждение в виде изолированных промежуточных продуктов (см. Следующий раздел) или других количественных и качественных характеристик реакции. Он также описывает каждое реактивное промежуточное соединение , активированный комплекс и переходное состояние , а также какие связи разрываются (и в каком порядке) и какие связи образуются (и в каком порядке). Полный механизм должен также объяснить причину используемых реагентов и катализатора , стереохимию, наблюдаемую в реагентах и продуктах, все образованные продукты и их количество.

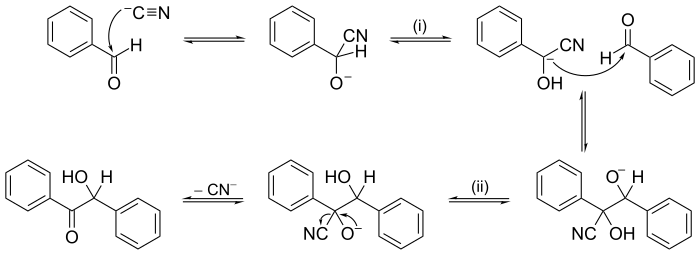
Метод толкания электрона или стрелки часто используется для иллюстрации механизма реакции; например, см. иллюстрацию механизма конденсации бензоина в следующем разделе примеров.
Механизм реакции также должен учитывать порядок, в котором реагируют молекулы. Часто то, что кажется одностадийным превращением, на самом деле является многоступенчатой реакцией.
Промежуточные продукты реакции
Промежуточные продукты реакции представляют собой химические соединения, часто нестабильные и недолговечные (однако иногда их можно выделить), которые не являются реагентами или продуктами общей химической реакции, а являются временными продуктами и / или реагентами на стадиях реакции механизма. Промежуточные продукты реакции часто представляют собой свободные радикалы или ионы .
Кинетика (относительные скорости стадий реакции и уравнение скорости для всей реакции) объясняется с точки зрения энергии, необходимой для превращения реагентов в предложенные переходные состояния (молекулярные состояния, которые соответствуют максимумам в координатах реакции , и к седловым точкам на поверхности потенциальной энергии для реакции).
Химическая кинетика
Информация о механизме реакции часто предоставляется путем использования химической кинетики для определения уравнения скорости и порядка реакции в каждом реагенте.
Рассмотрим, например, следующую реакцию:
- CO + NO 2 → CO 2 + NO
В этом случае эксперименты установили, что эта реакция протекает по закону скорости . Эта форма предполагает, что этап, определяющий скорость, представляет собой реакцию между двумя молекулами NO 2 . Возможный механизм общей реакции, объясняющий закон скорости:
- 2 NO 2 → NO 3 + NO (медленно)
- NO 3 + CO → NO 2 + CO 2 (быстро)
Каждый шаг называется элементарным, и у каждого есть свой закон скорости и молекулярность . Элементарные шаги должны составлять исходную реакцию. (Это означает, что если бы мы отменили все молекулы, которые появляются по обе стороны от реакции, мы остались бы с исходной реакцией.)
При определении общего закона скорости реакции самым медленным этапом является этап, определяющий скорость реакции. Поскольку первый шаг (в приведенной выше реакции) является самым медленным, это шаг, определяющий скорость . Поскольку в ней происходит столкновение двух молекул NO 2 , это бимолекулярная реакция, скорость которой подчиняется закону скорости .
Другие реакции могут иметь механизмы из нескольких последовательных этапов. В органической химии механизм реакции конденсации бензоина , предложенный в 1903 г. А. Дж. Лапвортом , был одним из первых предложенных механизмов реакции.
Цепная реакция является примером сложного механизма, в котором распространение ступень образует замкнутый цикл. В цепной реакции промежуточное соединение, полученное на одной стадии, образует промежуточное соединение на другой стадии. Промежуточные звенья называются переносчиками цепи. Иногда носителями цепи являются радикалы, они также могут быть ионами. При делении ядер они нейтроны.
Цепные реакции состоят из нескольких этапов, которые могут включать:
- 1. Инициирование цепи: это может быть термолиз или фотолиз, приводящий к разрыву связи. Термолиз означает нагревание молекул и фотолиз поглощения света.
- 2. Распространение: В этой цепи носитель делает другого носителя.
- 3. Ветвление: один перевозчик создает более одного перевозчика.
- 4. Замедление: носитель цепи может реагировать с продуктом, снижая скорость образования продукта. Это делает другой носитель цепи, но концентрация продукта снижается.
- 5. Обрыв цепи: радикалы объединяются, и носители цепи теряются.
- 6. Ингибирование. Носители цепи удаляются с помощью процессов, отличных от обрыва, например, путем образования радикалов.
Несмотря на то, что все эти шаги могут появиться в одной цепной реакции, минимально необходимыми являются: инициирование, распространение и завершение.
Примером простой цепной реакции является термическое разложение ацетальдегида (CH 3 CHO) до метана (CH 4 ) и монооксида углерода (CO). Порядок экспериментальной реакции равен 3/2, что можно объяснить механизмом Райса-Герцфельда .
Этот механизм реакции для ацетальдегида состоит из 4 ступеней со скоростными уравнениями для каждой ступени:
- 1. Инициирование: CH 3 CHO → • CH 3 + • CHO (скорость = k 1 [CH 3 CHO])
- 2. Распространение: CH 3 CHO + • CH 3 → CH 4 + CH 3 CO • (Скорость = k 2 [CH 3 CHO] [• CH 3 ])
- 3. Распространение: CH 3 CO • → • CH 3 + CO (скорость = k 3 [CH 3 CO •])
- 4. Прекращение: • CH 3 + • CH 3 → CH 3 CH 3 (скорость = k 4 [• CH 3 ] 2 )
Для всей реакции скорости изменения концентрации промежуточных соединений • CH 3 и CH 3 CO • равны нулю в соответствии с приближением стационарного состояния , которое используется для учета законов скорости цепных реакций.
d [• CH 3 ] / dt = k 1 [CH 3 CHO] - k 2 [• CH 3 ] [CH 3 CHO] + k 3 [CH 3 CO •] - 2k 4 [• CH 3 ] 2 = 0
и d [CH 3 CO •] / dt = k 2 [• CH 3 ] [CH 3 CHO] - k 3 [CH 3 CO •] = 0
Сумма этих двух уравнений равна k 1 [CH 3 CHO] - 2 k 4 [• CH 3 ] 2 = 0. Это можно решить, чтобы найти стационарную концентрацию радикалов • CH 3 как [• CH 3 ] = (k 1 / 2k 4 ) 1/2 [CH 3 CHO] 1/2 .
Отсюда следует, что скорость образования CH 4 равна d [CH 4 ] / dt = k 2 [• CH 3 ] [CH 3 CHO] = k 2 (k 1 / 2k 4 ) 1/2 [CH 3 CHO] 3 / 2
Таким образом, механизм объясняет наблюдаемое выражение скорости для основных продуктов CH 4 и CO. Точный закон скорости может быть еще более сложным, существуют также второстепенные продукты, такие как ацетон (CH 3 COCH 3 ) и пропаналь (CH 3 CH 2 CHO ).
Другие экспериментальные методы определения механизма
Было разработано множество экспериментов, которые предполагают возможную последовательность шагов в механизме реакции, в том числе:
- измерение влияния температуры ( уравнение Аррениуса ) для определения энергии активации
- спектроскопическое наблюдение промежуточных продуктов реакции
- определение стереохимии продуктов, например , в нуклеофильном замещении реакций
- измерение влияния изотопного замещения на скорость реакции
- для реакций в растворе измерение влияния давления на скорость реакции для определения изменения объема при образовании активированного комплекса
- для реакций ионов в растворе, измерение влияния ионной силы на скорость реакции
- прямое наблюдение активированного комплекса с помощью спектроскопии накачки и зонда
- инфракрасная хемилюминесценция для обнаружения колебательного возбуждения в продуктах
- масс-спектрометрия с ионизацией электрораспылением .
- кроссоверные эксперименты .
Теоретическое моделирование
Правильный механизм реакции - важная часть точного прогнозного моделирования . Для многих систем горения и плазмы подробные механизмы недоступны или требуют разработки.
Даже когда информация доступна, определение и сбор соответствующих данных из различных источников, согласование несовпадающих значений и экстраполяция на различные условия могут быть трудным процессом без помощи экспертов. Константы скорости или термохимические данные часто отсутствуют в литературе, поэтому для получения требуемых параметров необходимо использовать методы вычислительной химии или методы групповой аддитивности .
Методы вычислительной химии также можно использовать для расчета поверхностей потенциальной энергии для реакций и определения вероятных механизмов.
Молекулярность
Молекулярность в химии - это количество сталкивающихся молекулярных объектов , которые участвуют в одной стадии реакции .
- Стадия реакции с участием одного молекулярного объекта называется мономолекулярной.
- Стадия реакции с участием двух молекулярных единиц называется бимолекулярной.
- Стадия реакции с участием трех молекулярных единиц называется тримолекулярной или термолекулярной.
В общем, стадии реакции с участием более трех молекулярных объектов не происходят, потому что статистически маловероятно с точки зрения распределения Максвелла найти такое переходное состояние.
Смотрите также
- Органические реакции по механизму при органической реакции
- Нуклеофильное ацильное замещение
- Участие в соседней группе
- Реакция Финкельштейна
- Механизм Линдеманна
- Механизм электрохимической реакции
- Нуклеофильная абстракция
использованная литература
LGWADE, ОРГАНИЧЕСКАЯ ХИМИЯ, 7-е ИЗД., 2010 г.

![r = k [NO_ {2}] ^ {2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c34576960b3342cceed6c0b51b1764beb2dfcf4)

![{\ Displaystyle г = к [NO_ {2} (т)] ^ {2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/581dd3ba310fe8d53ab10b6a2ed319f4d67ed40a)