Микропептид - Micropeptide
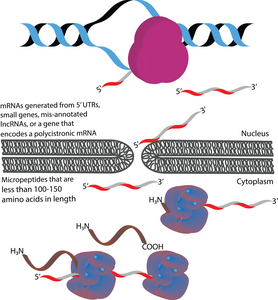
Микропептиды (также называемые микропротеинами) представляют собой полипептиды длиной менее 100–150 аминокислот , которые кодируются короткими открытыми рамками считывания (кОРС). В этом отношении они отличаются от многих других активных малых полипептидов, которые образуются в результате посттрансляционного расщепления более крупных полипептидов. По размеру микропептиды значительно короче «канонических» белков, которые в прокариотах и эукариотах имеют среднюю длину 330 и 449 аминокислот соответственно. Иногда микропептиды называют в соответствии с их геномным расположением. Например, транслированный продукт восходящей открытой рамки считывания (uORF) может быть назван пептидом, кодируемым uORF (uPEP). У микропептидов отсутствуют N-концевые сигнальные последовательности, что позволяет предположить, что они, вероятно, локализованы в цитоплазме . Однако некоторые микропептиды были обнаружены в других клеточных компартментах, на что указывает наличие трансмембранных микропептидов. Они обнаруживаются как у прокариот, так и у эукариот. КОРС, из которых транслируются микропептиды, могут кодироваться в 5 'UTR , малых генах или полицистронных мРНК . Некоторые гены, кодирующие микропептиды, изначально неправильно аннотировали как длинные некодирующие РНК (днРНК).
Из-за их небольшого размера кОРС изначально не рассматривались. Однако сотни тысяч предполагаемых микропептидов были идентифицированы с помощью различных методов у множества организмов. Только небольшая часть из них с кодирующим потенциалом получила подтверждение своей экспрессии и функции. Те, которые были функционально охарактеризованы, в целом, играют роль в передаче сигналов , органогенезе и клеточной физиологии . Чем больше обнаруживается микропептидов, тем больше их функций. Одной из регуляторных функций является функция пептопереключателей, которые ингибируют экспрессию нижестоящих кодирующих последовательностей путем остановки рибосом посредством их прямой или косвенной активации небольшими молекулами.
Идентификация
Существуют различные экспериментальные методы для идентификации потенциальных ORF и их трансляционных продуктов. Эти методы полезны только для идентификации кОРС, которая может продуцировать микропептиды, но не для прямой функциональной характеристики.
Секвенирование РНК
Одним из методов поиска потенциальных кОРС и, следовательно, микропептидов является секвенирование РНК ( RNA-Seq ). RNA-Seq использует секвенирование следующего поколения (NGS), чтобы определить, какие РНК экспрессируются в данной клетке, ткани или организме в определенный момент времени. Этот набор данных, известный как транскриптом , затем можно использовать в качестве ресурса для поиска потенциальных кОРС. Из-за высокой вероятности случайного появления кОРС менее 100 а.о. необходимы дальнейшие исследования для определения достоверности данных, полученных с помощью этого метода.
Профилирование рибосом (Ribo-Seq)
Профилирование рибосом используется для идентификации потенциальных микропептидов у растущего числа организмов, включая плодовых мушек, рыбок данио, мышей и людей. В одном методе используются такие соединения, как харрингтонин, пуромицин или лактимидомицин, для остановки рибосом в сайтах инициации трансляции. Это указывает, где происходит активный перевод. Ингибиторы удлинения трансляции, такие как эметин или циклогексимид, также можно использовать для получения следов рибосом, которые с большей вероятностью приведут к транслированной ORF. Если рибосома связана с кОРС или рядом с ней, она предположительно кодирует микропептид.
Масс-спектрометрии
Масс-спектрометрия (МС) - золотой стандарт для идентификации и секвенирования белков. Используя этот метод, исследователи могут определить, действительно ли полипептиды транслируются с кОРС.
Протеогеномные приложения
Протеогеномика сочетает протеомику, геномику и транскиптомику. Это важно при поиске потенциальных микропептидов. Один из методов использования протеогеномики предполагает использование данных RNA-Seq для создания настраиваемой базы данных всех возможных полипептидов. Для получения информации о последовательностях продуктов трансляции проводят жидкостную хроматографию с последующей тандемной масс-спектрометрией (LC-MS / MS). Сравнение транскриптомных и протеомных данных можно использовать для подтверждения присутствия микропептидов.
Филогенетическая консервация
Филогенетическая консервация может быть полезным инструментом, особенно при просмотре большой базы данных кОРС. Вероятность того, что кОРС приведет к образованию функционального микропептида, более высока, если он сохраняется у многих видов. Однако это не сработает для всех кОРС. Например, те, которые кодируются днРНК, с меньшей вероятностью будут консервативными, поскольку сами днРНК не обладают высокой консервативностью последовательности. Необходимы дальнейшие эксперименты, чтобы определить, действительно ли продуцируется функциональный микропептид.
Подтверждение потенциала кодирования белков
Антитела
Пользовательские антитела, нацеленные на интересующий микропептид, могут быть полезны для количественной оценки экспрессии или определения внутриклеточной локализации. Как и в случае с большинством белков, низкая экспрессия может затруднить обнаружение. Небольшой размер микропептида также может привести к трудностям в разработке эпитопа, из которого нацелено антитело.
Добавление тегов с помощью CRISPR-Cas9
Редактирование генома можно использовать для добавления FLAG / MYC или других небольших пептидных тегов к эндогенной кОРС, создавая таким образом гибридные белки. В большинстве случаев этот метод выгоден тем, что его можно выполнить быстрее, чем разработка собственного антитела. Это также полезно для микропептидов, для которых нельзя нацелить эпитоп.
Перевод in vitro
Этот процесс включает клонирование полноразмерной кДНК микропептида в плазмиду, содержащую промотор T7 или SP6. В этом методе используется бесклеточная система синтеза белка в присутствии 35 S-метионина для получения интересующего пептида. Затем продукты могут быть проанализированы с помощью гель-электрофореза, и пептид, меченный 35 S, визуализируется с помощью авторадиографии.
Базы данных и репозитории
Существует несколько репозиториев и баз данных, которые были созданы как для кОРС, так и для микропептидов. Репозиторий небольших ORF, обнаруженных с помощью профилирования рибосом, можно найти на сайте sORFs.org. Репозиторий предполагаемых кодируемых кОРС пептидов в Arabidopsis thaliana можно найти в ARA-PEPs. Базу данных малых белков, особенно кодируемых некодирующими РНК, можно найти на SmProt.
Прокариотические примеры
На сегодняшний день большинство микропептидов идентифицировано в прокариотических организмах. Хотя большинство из них еще предстоит полностью охарактеризовать, многие из них, по-видимому, имеют решающее значение для выживания этих организмов. Из-за своего небольшого размера прокариоты особенно восприимчивы к изменениям в окружающей их среде, и поэтому они разработали методы, обеспечивающие их существование.
Кишечная палочка (кишечная палочка)
Микропептиды, экспрессируемые в E. coli, служат примером адаптации бактерий к окружающей среде. Большинство из них было разделено на три группы: лидерные пептиды, рибосомные белки и токсичные белки. Белки-лидеры регулируют транскрипцию и / или трансляцию белков, участвующих в метаболизме аминокислот, когда аминокислот не хватает. Рибосомные белки включают L36 ( rpmJ ) и L34 ( rpmH ), два компонента 50S субъединицы рибосомы. Токсичные белки, такие как ldrD , токсичны на высоких уровнях и могут убивать клетки или подавлять рост, что снижает жизнеспособность клетки-хозяина.
Salmonella enterica (S. enterica)
У S. enterica фактор вирулентности MgtC участвует в адаптации к среде с низким содержанием магния. Гидрофобный пептид MgrR связывается с MgtC, вызывая его расщепление протеазой FtsH.
Bacillus subtilis (B. subtilis)
Микропептид Sda из 46 аминокислотных остатков, экспрессируемый B. subtilis , подавляет споруляцию, когда инициация репликации нарушена. Ингибируя гистидинкиназу KinA, Sda предотвращает активацию фактора транскрипции Spo0A, который необходим для споруляции.
Золотистый стафилококк (S. aureus)
В S. aureus есть группа микропептидов, 20-22 а.о., которые выделяются во время инфекции хозяина, разрушая мембраны нейтрофилов, вызывая лизис клеток. Эти микропептиды позволяют бактериям избегать разрушения основными защитными механизмами иммунной системы человека.
Примеры эукариот
Микропептиды были обнаружены в эукариотических организмах от Arabidopsis thaliana до человека. После полного развития они играют разнообразные роли в развитии тканей и органов, а также в поддержании и функционировании. Хотя многие из них еще не охарактеризованы функционально и, вероятно, еще предстоит открыть, ниже приводится краткое изложение недавно идентифицированных функций эукариотических микропептидов.
Arabidopsis thaliana ( A. thaliana )
Ген POLARIS (PLS) кодирует микропептид из 36 аминокислотных остатков. Это необходимо для правильного формирования сосудистого рисунка листка и роста клеток в корне. Этот микропептид взаимодействует с онтогенетическими белками PIN, образуя критическую сеть для гормонального взаимодействия между ауксином, этиленом и цитокинином.
РОТУНДИФОЛИЯ (ROT4 ) в A. thaliana кодирует пептид из 53 аминокислотных остатков, который локализуется на плазматической мембране клеток листа. Механизм функции ROT4 не совсем понятен, но мутанты имеют короткие округлые листья, что указывает на то, что этот пептид может играть важную роль в морфогенезе листа.
Зеа майс ( Z. mays )
Brick1 (Brk1) кодирует микропептид из 76 аминокислотных остатков, который является высококонсервативным как у растений, так и у животных. У Z. mays было обнаружено, что он участвует в морфогенезе эпителия листа, способствуя множественным актин-зависимым событиям поляризации клеток в развивающемся эпидермисе листа. Zm401p10 представляет собой микропептид из 89 аминокислотных остатков, который играет роль в нормальном развитии пыльцы тапетума. После митоза он также играет важную роль в деградации тапетума. Zm908p11 представляет собой микропептид длиной 97 а.о., кодируемый геном Zm908 , который экспрессируется в зрелых пыльцевых зернах. Он локализуется в цитоплазме пыльцевых трубок, где способствует их росту и развитию.
Drosophila melanogaster ( D. melanogaster ).
Эволюционно консервативный ген полированного риса ( pri ), известный как tarsalless (tal) у D. melanogaster , участвует в дифференцировке эпидермиса. Этот полицистронный транскрипт кодирует четыре подобных пептида, длина которых составляет от 11 до 32 аминокислотных остатков. Они работают, чтобы усечь фактор транскрипции Shavenbaby (Svb). Это превращает Svb в активатор, который напрямую регулирует экспрессию целевых эффекторов, включая миниатюрные (m) и бритоидные (sha) , которые вместе несут ответственность за образование трихомов .
Данио рерио ( D. rerio )
Ген Elabela ( Ela) (он же Apela, Toddler) важен для эмбриогенеза. Он особенно выражен на поздних стадиях бластулы и гаструлы. Во время гаструляции , это имеет решающее значение в содействии интернализации и животные-полюса , направленное движение Mes энтодермальных клеток. После гаструляции Ela экспрессируется в латеральной мезодерме, энтодерме, а также в передней и задней хорде. Хотя она была аннотирована как lncRNA у рыбок данио, мышей и человека, было обнаружено, что ORF из 58 аминокислотных остатков является высококонсервативной среди видов позвоночных. Ela процессируется путем удаления его сигнального пептида на N-конце и затем секретируется во внеклеточное пространство . Его зрелый пептид из 34 аминокислотных остатков служит первым эндогенным лигандом для GPCR, известного как рецептор апелина . Генетическая инактивация Ela или Aplnr у рыбок данио приводит к бессердечным фенотипам.
Mus musculus ( M. musculus )
Миорегулин ( Mln ) кодируется геном, изначально аннотированным как lncRNA. Mln экспрессируется во всех 3 типах скелетных мышц и действует аналогично микропептидам фосфоламбана (Pln) в сердечной мышце и сарколипину (Sln) в медленных скелетных мышцах (тип I). Эти микропептидов взаимодействуют с саркоплазматического ретикулума Ca 2+ -АТФазы (Serca), мембранный насос , ответственного за регулирование Ca 2+ поглощение в саркоплазматического ретикулума (СР). Ингибируя захват Ca 2+ в SR, они вызывают расслабление мышц. Точно так же гены эндорегулина (ELN) и другого регулина (ALN) кодируют трансмембранные микропептиды, которые содержат мотив связывания SERCA и консервативны у млекопитающих.
Myomixer (Mymx) кодируется геном Gm7325, мышечно-специфическим пептидом длиной 84 а.о., который играет роль во время эмбриогенеза в слиянии и формировании скелетных мышц. Он локализуется на плазматической мембране, связываясь с фузогенным мембранным белком Myomaker (Mymk). У людей ген, кодирующий Mymx, обозначен как не охарактеризованный LOC101929726 . Ортологи также встречаются в геномах черепах, лягушек и рыб.
Человек разумный ( H. sapiens )
У человека NoBody ( неаннотированный диссоциирующий полипептид Р-тельца), микропептид из 68 аминокислот, был обнаружен в длинной промежуточной некодирующей РНК (lincRNA) LINC01420 . Он имеет высокую сохранность последовательности среди млекопитающих и локализуется в Р-теле . Он обогащает белки, связанные с декапированием 5'-мРНК . Считается, что он напрямую взаимодействует с энхансером мРНК Decapping 4 (EDC4).
ELABELA ( ELA) (также известный как APELA) - это эндогенный гормон, который секретируется эмбриональными стволовыми клетками человека в виде микропептида из 32 аминокислот. Это имеет важное значение для поддержания самообновления и плюрипотентности человеческих эмбриональных стволовых клеток . Его сигналы аутокринны черезпуть PI3 / AKT через еще не идентифицированный рецептор клеточной поверхности . При дифференцировке мезоэнермальных клеток ELA связывается с APLNR и сигнализирует через него , GPCR, который также может отвечать на гормональный пептид APLN .
Ген C7orf49 , консервативный у млекопитающих, при альтернативном сплайсинге, по прогнозам, продуцирует три микропептида. Ранее было обнаружено, что МРТ-1 является модулятором ретровирусной инфекции. Второй предсказанный микропептид, MRI-2, может играть важную роль в негомологичном соединении концов (NHEJ) двухцепочечных разрывов ДНК. В экспериментах по коиммунопреципитации MRI-2 связывается с Ku70 и Ku80 , двумя субъединицами Ku , которые играют важную роль в пути NHEJ.
Микропептид из 24 аминокислот, Humanin (HN), взаимодействует с индуцирующим апоптоз белком Bcl2-ассоциированным X-белком (Bax). В активном состоянии Bax претерпевает конформационные изменения, которые открывают домены, нацеленные на мембрану. Это заставляет его перемещаться из цитозоля на митохондриальную мембрану, где он вставляет и высвобождает апоптогенные белки, такие как цитохром c. Взаимодействуя с Bax, HN предотвращает нацеливание Bax на митохондрии, тем самым блокируя апоптоз.
Было обнаружено, что микропептид 90aa, « Малый регуляторный полипептид аминокислотного ответа » или SPAAR, кодируется днРНК LINC00961 . Он сохраняется у человека и мыши и локализуется в поздних эндосомах / лизосомах. SPAAR взаимодействует с четырьмя субъединицами комплекса v-АТФазы , ингибируя транслокацию mTORC1 на поверхность лизосомы, где он активируется. Подавление этого микропептида делает возможным активацию mTORC1 за счет аминокислотной стимуляции, способствуя регенерации мышц.
Рекомендации
![]() Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 ( 2018 г. ) ( отчеты рецензента ):
Мария Е. Соуза; Майкл Х. Фаркас (13 декабря 2018 г.). «Микропептид» . PLOS Genetics . 14 (12): e1007764. DOI : 10.1371 / JOURNAL.PGEN.1007764 . ISSN 1553-7390 . PMC 6292567 . PMID 30543625 . Викиданные Q60017699 .
Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 ( 2018 г. ) ( отчеты рецензента ):
Мария Е. Соуза; Майкл Х. Фаркас (13 декабря 2018 г.). «Микропептид» . PLOS Genetics . 14 (12): e1007764. DOI : 10.1371 / JOURNAL.PGEN.1007764 . ISSN 1553-7390 . PMC 6292567 . PMID 30543625 . Викиданные Q60017699 .
- ^ a b c d e f g Crappé J, Van Criekinge W, Menschaert G (2014). «Маленькие вещи делают большие дела: краткое изложение генов, кодирующих микропептиды» . Открытая протеомика EuPA . 3 : 128–137. DOI : 10.1016 / j.euprot.2014.02.006 .
- ^ a b c d e f g Makarewich CA, Olson EN (сентябрь 2017 г.). «Добыча микропептидов» . Тенденции в клеточной биологии . 27 (9): 685–696. DOI : 10.1016 / j.tcb.2017.04.006 . PMC 5565689 . PMID 28528987 .
- ^ Гильен G, Диас-Камин С, Лойол-Торрес СА, Апарисио-Фабр R, Ернандес-López А, Диас-Санчес М, Санчес F (2013). «Подробный анализ предполагаемых генов, кодирующих небольшие белки в геномах бобовых» . Границы растениеводства . 4 : 208. DOI : 10.3389 / fpls.2013.00208 . PMC 3687714 . PMID 23802007 .
- Перейти ↑ Hashimoto Y, Kondo T, Kageyama Y (июнь 2008 г.). «В центре внимания лилипуты: новый класс малых пептидных генов в морфогенезе» . Развитие, рост и дифференциация . 50 Приложение 1: S269–76. DOI : 10.1111 / j.1440-169x.2008.00994.x . PMID 18459982 .
- ^ Чжан Дж (март 2000). «Распределение длин белков для трех областей жизни». Тенденции в генетике . 16 (3): 107–9. DOI : 10.1016 / s0168-9525 (99) 01922-8 . PMID 10689349 .
- ^ Rothnagel J, Menschaert G (май 2018). «Короткие открытые рамки для чтения и закодированные в них пептиды» . Протеомика . 18 (10): e1700035. DOI : 10.1002 / pmic.201700035 . PMID 29691985 .
- ^ a b Андерсон Д.М., Андерсон К.М., Чанг К.Л., Макаревич, Калифорния, Нельсон Б.Р., Маканалли Дж. Р., Касарагод П., Шелтон Дж. М., Лиу Дж., Бассел-Дуби Р., Олсон, EN (февраль 2015 г.). «Микропептид, кодируемый предполагаемой длинной некодирующей РНК, регулирует работу мышц» . Cell . 160 (4): 595–606. DOI : 10.1016 / j.cell.2015.01.009 . PMC 4356254 . PMID 25640239 .
- ^ а б Би П., Рамирес-Мартинес А., Ли Х., Каннавино Дж., Маканалли Дж. Р., Шелтон Дж. М., Санчес-Ортис Е., Бассель-Дуби Р., Олсон Е. Н. (апрель 2017 г.). «Контроль мышечного образования миомиксером с микропептидами слияния» . Наука . 356 (6335): 323–327. Bibcode : 2017Sci ... 356..323B . DOI : 10.1126 / science.aam9361 . PMC 5502127 . PMID 28386024 .
- ^ a b Аликс Е., Blanc-Potard AB (февраль 2008 г.). «Пептидная деградация фактора вирулентности Salmonella MgtC» . Журнал EMBO . 27 (3): 546–57. DOI : 10.1038 / sj.emboj.7601983 . PMC 2241655 . PMID 18200043 .
- ^ a b Burkholder WF, Kurtser I, Grossman AD (январь 2001 г.). «Белки инициации репликации регулируют контрольную точку развития Bacillus subtilis». Cell . 104 (2): 269–79. DOI : 10.1016 / s0092-8674 (01) 00211-2 . ЛВП : 1721,1 / 83916 . PMID 11207367 . S2CID 15048130 .
- ^ а б в г д Эндрюс SJ, Ротнагель JA (март 2014). «Новые доказательства функциональных пептидов, кодируемых короткими открытыми рамками считывания». Обзоры природы. Генетика . 15 (3): 193–204. DOI : 10.1038 / nrg3520 . PMID 24514441 . S2CID 22543778 .
- ^ a b Баззини А.А., Джонстон Т.Г., Кристиано Р., Макковяк С.Д., Обермайер Б., Флеминг Е.С., Вейнар С.Э., Ли М.Т., Раевски Н., Вальтер Т.К., Хиральдез А.Дж. (май 2014 г.). «Идентификация малых ORF у позвоночных с использованием рибосомного следа и эволюционного сохранения» . Журнал EMBO . 33 (9): 981–93. DOI : 10.1002 / embj.201488411 . PMC 4193932 . PMID 24705786 .
- ^ Ingolia NT, Brar Г.А., Stern-Ginossar N, Harris MS, Talhouarne GJ, Джексон SE, Wills MR, Вайсман JS (сентябрь 2014). «Профилирование рибосом выявляет повсеместную трансляцию вне аннотированных генов, кодирующих белок» . Отчеты по ячейкам . 8 (5): 1365–79. DOI : 10.1016 / j.celrep.2014.07.045 . PMC 4216110 . PMID 25159147 .
- ^ Стерн-Ginossar N, Ingolia НТ (ноябрь 2015). «Профилирование рибосом как инструмент для расшифровки вирусной сложности». Ежегодный обзор вирусологии . 2 (1): 335–49. DOI : 10.1146 / annurev-virology-100114-054854 . PMID 26958919 .
- ^ "sORFs.org: хранилище небольших ORF, идентифицированных с помощью профилирования рибосом" . sorfs.org . Проверено 14 декабря 2018 .
- ^ Olexiouk В, Crappé Дж, Verbruggen S, Verhegen К, Мартенс л, Menschaert G (январь 2016). "sORFs.org: хранилище небольших ORF, идентифицированных с помощью профилирования рибосом" . Исследования нуклеиновых кислот . 44 (D1): D324–9. DOI : 10.1093 / NAR / gkv1175 . PMC 4702841 . PMID 26527729 .
- ^ "ARA-PEPs: Репозиторий предполагаемых sORF-кодируемых пептидов в Arabidopsis thaliana " . www.biw.kuleuven.be . Проверено 14 декабря 2018 .
- ^ Hazarika RR, De Coninck B, Yamamoto LR, Martin LR, Cammue BP, ван Ноорт V (январь 2017). «ARA-PEPs: репозиторий предполагаемых пептидов, кодируемых sORF, в Arabidopsis thaliana» . BMC Bioinformatics . 18 (1): 37. DOI : 10,1186 / s12859-016-1458-у . PMC 5240266 . PMID 28095775 .
- ^ "SmProt: база данных малых белков, кодируемых аннотированными кодирующими и некодирующими локусами РНК" . bioinfo.ibp.ac.cn . Проверено 14 декабря 2018 .
- ↑ Хао И, Чжан Л., Ню И, Цай Т., Ло Дж, Хэ С, Чжан Б., Чжан Д., Цинь И, Ян Ф, Чен Р. (июль 2018 г.). «SmProt: база данных малых белков, кодируемых аннотированными кодирующими и некодирующими локусами РНК». Брифинги по биоинформатике . 19 (4): 636–643. DOI : 10.1093 / нагрудник / bbx005 . PMID 28137767 .
- ^ Hemm MR, Пол BJ, Schneider TD, Storz G, Rudd KE (декабрь 2008). «Малые мембранные белки, обнаруженные с помощью сравнительной геномики и моделей сайта связывания рибосом» . Молекулярная микробиология . 70 (6): 1487–501. DOI : 10.1111 / j.1365-2958.2008.06495.x . PMC 2614699 . PMID 19121005 .
- ^ Ван R, Braughton KR, Кречмер D, Бах TH, Queck SY, Ли М, Кеннеди Д., Dorward DW, клебановский SJ, Peschel A, DeLeo FR, Otto M (декабрь 2007). «Идентификация новых цитолитических пептидов в качестве ключевых детерминант вирулентности для ассоциированного с сообществом MRSA». Природная медицина . 13 (12): 1510–4. DOI : 10.1038 / nm1656 . PMID 17994102 . S2CID 8465052 .
- ^ Hemm MR, Пол BJ, Миранда-Риос Дж, Чжан А, Soltanzad Н, Шторц G (январь 2010). «Малые белки стрессовой реакции в Escherichia coli: белки, пропущенные классическими протеомными исследованиями» . Журнал бактериологии . 192 (1): 46–58. DOI : 10.1128 / jb.00872-09 . PMC 2798279 . PMID 19734316 .
- ^ Кассон SA, Chilley PM, Топпинг JF, Эванс М., Сутер М., Lindsey K (август 2002). «Ген POLARIS Arabidopsis кодирует предсказанный пептид, необходимый для правильного роста корней и формирования сосудистого паттерна листьев» . Растительная клетка . 14 (8): 1705–21. DOI : 10.1105 / tpc.002618 . PMC 151460 . PMID 12172017 .
- ^ Chilley PM, Кассон SA, Тарковский P, N Hawkins, Ван KL, Хасси PJ, Бил M, Экер JR, Сандберг GK, Lindsey K (ноябрь 2006). «Пептид POLARIS Arabidopsis регулирует транспорт ауксина и рост корней посредством воздействия на передачу сигналов этилена» . Растительная клетка . 18 (11): 3058–72. DOI : 10.1105 / tpc.106.040790 . PMC 1693943 . PMID 17138700 .
- Перейти ↑ Liu J, Mehdi S, Topping J, Friml J, Lindsey K (2013). «Взаимодействие PLS и PIN и гормональные перекрестные помехи в развитии корня Arabidopsis» . Границы растениеводства . 4 : 75. DOI : 10.3389 / fpls.2013.00075 . PMC 3617403 . PMID 23577016 .
- ↑ Нарита Н.Н., Мур С., Хоригучи Г., Кубо М., Демура Т., Фукуда Н., Гудрич Дж., Цукая Н. (май 2004 г.). «Сверхэкспрессия нового малого пептида ROTUNDIFOLIA4 снижает пролиферацию клеток и изменяет форму листа у Arabidopsis thaliana». Заводской журнал . 38 (4): 699–713. DOI : 10.1111 / j.1365-313x.2004.02078.x . PMID 15125775 .
- ↑ Франк MJ, Смит LG (май 2002 г.). «Небольшой новый белок, высококонсервативный у растений и животных, способствует поляризованному росту и делению эпидермальных клеток листьев кукурузы» . Текущая биология . 12 (10): 849–53. DOI : 10.1016 / s0960-9822 (02) 00819-9 . PMID 12015123 . S2CID 14725039 .
- ^ Ван Д., Ли С, Чжао Q, Чжао Л., Ван М., Чжу Д., Ао Г, Ю Дж (2009). «Zm401p10, кодируемый специфическим для пыльника геном с короткими открытыми рамками считывания, необходим для дегенерации тапетума и развития пыльника у кукурузы». Функциональная биология растений . 36 (1): 73–85. DOI : 10.1071 / fp08154 . PMID 32688629 .
- Перейти ↑ Dong X, Wang D, Liu P, Li C, Zhao Q, Zhu D, Yu J (май 2013 г.). «Zm908p11, кодируемый геном короткой открытой рамки считывания (кОРС), функционирует при росте пыльцевых трубок как лиганд профилина кукурузы» . Журнал экспериментальной ботаники . 64 (8): 2359–72. DOI : 10.1093 / JXB / ert093 . PMC 3654424 . PMID 23676884 .
- ^ Кондо Т, площадь S, Занет Дж, Benrabah Е, Р Валенти, Хасимото Y, Кобаяши S, Payre F, Кагеяма Y (июль 2010 г.). «Малые пептиды переключают транскрипционную активность Shavenbaby во время эмбриогенеза дрозофилы». Наука . 329 (5989): 336–9. Bibcode : 2010Sci ... 329..336K . DOI : 10.1126 / science.1188158 . PMID 20647469 . S2CID 2927777 .
- ^ a b c Chng SC, Ho L, Tian J, Reversade B (декабрь 2013 г.). «ELABELA: гормон, необходимый для сигналов развития сердца через рецептор апелина» . Клетка развития . 27 (6): 672–80. DOI : 10.1016 / j.devcel.2013.11.002 . PMID 24316148 .
- ^ Паули A, Норрис ML, Вален E, Chew GL, Gagnon JA, Zimmerman S, Mitchell A, Ma J, Dubrulle J, Reyon D, Tsai SQ, Joung JK, Saghatelian A, Schier AF (февраль 2014). «Малыш: эмбриональный сигнал, который способствует движению клеток через рецепторы апелина» . Наука . 343 (6172): 1248636. DOI : 10.1126 / science.1248636 . PMC 4107353 . PMID 24407481 .
- ^ Дешвар, Ашиш Р; Chng, Serene C; Хо, Лена; Reversade, Бруно; Скотт, Ян К. (2016-04-14). Робертсон, Элизабет (ред.). «Рецептор апелина усиливает передачу сигналов Nodal / TGFβ для обеспечения правильного сердечного развития» . eLife . 5 : e13758. DOI : 10.7554 / eLife.13758 . ISSN 2050-084X . PMC 4859801 . PMID 27077952 .
- ^ Скотт, Ян С .; Масри, Бернард; Д'Амико, Леонард А .; Джин, Сук-Вон; Юнгблут, Бенно; Wehman, Ann M .; Байер, Хервиг; Audigier, Ив; Стенье, Дидье Ю. Р. (март 2007 г.). «Рецептор, связанный с g-белком, agtrl1b, регулирует раннее развитие миокардиальных предшественников» . Клетка развития . 12 (3): 403–413. DOI : 10.1016 / j.devcel.2007.01.012 . ISSN 1534-5807 . PMID 17336906 .
- ↑ D'Lima NG, Ma J, Winkler L, Chu Q, Loh KH, Corpuz EO, Budnik BA, Lykke-Andersen J, Saghatelian A, Slavoff SA (февраль 2017 г.). «Человеческий микропротеин, который взаимодействует с комплексом обезглавливания мРНК» . Природа Химическая биология . 13 (2): 174–180. DOI : 10.1038 / nchembio.2249 . PMC 5247292 . PMID 27918561 .
- ^ Хо, Лена; Тан, Шон YX; Ви, Шина; У, Исюань; Тан, Сэм Дж. К.; Рамакришна, Навин Б .; Chng, Serene C .; Нама, шрикантх; Щербинская, Ивона; Щербинская, Ивона; Чан, Юн-Шен (01.10.2015). «ELABELA - это эндогенный фактор роста, который поддерживает самообновление hESC через путь PI3K / AKT» . Стволовая клетка . 17 (4): 435–447. DOI : 10.1016 / j.stem.2015.08.010 . ISSN 1875-9777 . PMID 26387754 .
- ^ Slavoff SA, Хео J, Будник Б.А., Hanakahi Л.А., Сагателян A (апрель 2014). «Человеческий полипептид, кодирующий короткую открытую рамку считывания (кОРС), который стимулирует соединение концов ДНК» . Журнал биологической химии . 289 (16): 10950–7. DOI : 10,1074 / jbc.c113.533968 . PMC 4036235 . PMID 24610814 .
- ↑ Guo B, Zhai D, Cabezas E, Welsh K, Nouraini S, Satterthwait AC, Reed JC (май 2003 г.). «Пептид гуманина подавляет апоптоз, препятствуя активации Bax». Природа . 423 (6938): 456–61. Bibcode : 2003Natur.423..456G . DOI : 10,1038 / природа01627 . PMID 12732850 . S2CID 4423176 .
- ↑ Мацумото А., Пасут А., Мацумото М., Ямасита Р., Фунг Дж., Монтелеоне Е., Сагателиан А., Накаяма К. И., Клохесси Дж. Г., Пандольфи П. П. (январь 2017 г.). «mTORC1 и регенерация мышц регулируются полипептидом SPAR, кодируемым LINC00961». Природа . 541 (7636): 228–232. Bibcode : 2017Natur.541..228M . DOI : 10,1038 / природа21034 . PMID 28024296 . S2CID 205253245 .