Гидроксид меди (II) - Copper(II) hydroxide

|
|

|
|
| Имена | |
|---|---|
|
Название ИЮПАК
Гидроксид меди (II)
|
|
| Другие названия
Гидроксид меди
|
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.039.817 |
| КЕГГ | |
|
PubChem CID
|
|
| UNII | |
|
Панель управления CompTox ( EPA )
|
|
|
|
|
|
| Характеристики | |
| Cu (OH) 2 | |
| Молярная масса | 97,561 г / моль |
| Появление | Синее или сине-зеленое твердое вещество |
| Плотность | 3,368 г / см 3 , твердый |
| Температура плавления | 80 ° C (176 ° F, 353 K) (разлагается на CuO ) |
| незначительный | |
|
Произведение растворимости ( K уд )
|
2,20 х 10 −20 |
| Растворимость | не растворим в этаноле ; растворим в NH 4 OH |
| + 1170,0 · 10 −6 см 3 / моль | |
| Термохимия | |
|
Стандартная мольная
энтропия ( S |
108 Дж · моль −1 · K −1 |
|
Std энтальпия
формации (Δ F H ⦵ 298 ) |
−450 кДж · моль −1 |
| Опасности | |
| Основные опасности | Раздражает кожу, глаза и дыхательные пути |
| Паспорт безопасности | http://www.sciencelab.com/xMSDS-Cupric_Hydroxide-9923594 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Не воспламеняется |
| Смертельная доза или концентрация (LD, LC): | |
|
LD 50 ( средняя доза )
|
1000 мг / кг (перорально, крыса) |
| NIOSH (пределы воздействия на здоровье в США): | |
|
PEL (Допустимо)
|
TWA 1 мг / м 3 (как Cu) |
|
REL (рекомендуется)
|
TWA 1 мг / м 3 (как Cu) |
|
IDLH (Непосредственная опасность)
|
TWA 100 мг / м 3 (как Cu) |
| Родственные соединения | |
|
Другие анионы
|
Оксид меди (II) Карбонат меди (II) Сульфат меди (II) Хлорид меди (II) |
|
Другие катионы
|
Гидроксид никеля (II) Гидроксид цинка Гидроксид железа (II) Гидроксид кобальта |
|
Родственные соединения
|
Оксид меди (I) Хлорид меди (I) |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Медь (II) , гидроксид представляет собой гидроксид из меди с химической формулой из Cu (OH) 2 . Это бледно-зеленовато-синее или голубовато-зеленое твердое вещество. Некоторые формы гидроксида меди (II) продаются как «стабилизированный» гидроксид меди (II), хотя они, вероятно, состоят из смеси карбоната и гидроксида меди (II) . Гидроксид меди является сильным основанием, хотя его низкая растворимость в воде затрудняет непосредственное наблюдение.
Вхождение
Гидроксид меди (II) известен с момента начала выплавки меди около 5000 г. до н.э., хотя алхимики, вероятно, были первыми, кто изготовил его, смешивая растворы щелока (гидроксид натрия или калия) и голубой купорос (сульфат меди (II)). Источники обоих соединений были доступны еще в древности.
Он производился в промышленных масштабах в 17-18 веках для использования в пигментах, таких как синий вердитер и бременский зеленый . Эти пигменты использовались в керамике и живописи .
Лабораторный синтез
Гидроксид меди (II) можно получить, добавляя гидроксид натрия к разбавленному раствору сульфата меди (II) (CuSO 4 · 5H 2 O). Однако полученный таким образом осадок часто содержит воду и заметное количество примеси гидроксида натрия. Более чистый продукт можно получить, если предварительно добавить в раствор хлорид аммония . В качестве альтернативы гидроксид меди легко получить электролизом воды (содержащей небольшое количество электролита, такого как сульфат натрия или сульфат магния ) с медным анодом .
Минеральная
Минерал формулы Cu (OH) 2 называется спертиниитом . Гидроксид меди (II) редко встречается как несвязанный минерал, потому что он медленно вступает в реакцию с диоксидом углерода из атмосферы с образованием основного карбоната меди (II) . Таким образом, медь медленно приобретает тускло-зеленый налет во влажном воздухе в результате реакции:
- 2 Cu (OH) 2 + CO 2 → Cu 2 CO 3 (OH) 2 + H 2 O
Необработанный материал в принципе представляет собой мольную смесь 1: 1 Cu (OH) 2 и CuCO 3 . Эта патина образует бронзу и другие статуи из медного сплава, такие как Статуя Свободы .
Состав
Структура Cu (OH) 2 была определена с помощью рентгеновской кристаллографии . Медный центр имеет квадратно-пирамидальную форму. Четыре расстояния Cu-O в диапазоне плоскости равны 1,96 Å, а аксиальное расстояние Cu-O составляет 2,36 Å. Гидроксид лиганды в плоскости либо двукратно моста или трехкратно моста.
Реакции
Он стабилен примерно до 100 ° C.
Гидроксид меди (II) реагирует с раствором аммиака с образованием темно-синего раствора комплексного иона тетрамминмеди [Cu (NH 3 ) 4 ] 2+ .
Гидроксид меди (II) катализирует окисление растворов аммиака в присутствии дикислорода, в результате чего образуются нитриты аммиака меди, такие как Cu (NO 2 ) 2 (NH 3 ) n .
Гидроксид меди (II) умеренно амфотерный . Слабо растворяется в концентрированной щелочи , образуя [Cu (OH) 4 ] 2– .
Реагент для органической химии
Гидроксид меди (II) играет довольно специализированную роль в органическом синтезе . Часто, когда его используют для этой цели, его получают на месте путем смешивания растворимой соли меди (II) и гидроксида калия .
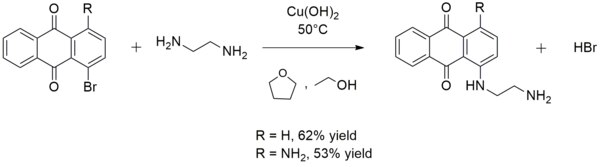
Это иногда используется в синтезе арильных аминов . Например, гидроксид меди (II) катализирует реакцию этилендиамина с 1-бромантрахиноном или 1-амино-4-бромантрахиноном с образованием 1 - ((2-аминоэтил) амино) антрахинона или 1-амино-4 - ((2-аминоэтил ) амино) антрахинон соответственно:
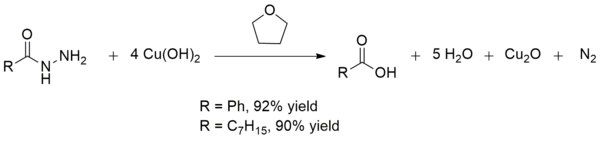
Меди (II) гидроксид также преобразуют кислоты гидразидов до карбоновых кислот при комнатной температуре. Это превращение полезно при синтезе карбоновых кислот в присутствии других хрупких функциональных групп . Выходы обычно превосходны, как в случае с производством бензойной кислоты и октановой кислоты :
Использует
Гидроксид меди (II) в растворе аммиака, известный как реагент Швейцера , обладает интересной способностью растворять целлюлозу . Это свойство привело к его использованию в производстве вискозы , целлюлозного волокна .
Он также широко используется в аквариумной промышленности из-за своей способности уничтожать внешних паразитов у рыб, включая сосальщиков, морских их, ручейков и морских бархатов, не убивая рыб. Хотя другие водорастворимые соединения меди могут быть эффективными в этой роли, они обычно приводят к высокой смертности рыб.
Гидроксид меди (II) использовался как альтернатива бордосской смеси , фунгициду и нематициду . К таким продуктам относится Kocide 3000, производимый Kocide LLC. Гидроксид меди (II) также иногда используется в качестве красителя для керамики .
Гидроксид меди (II) был объединен с латексной краской, создав продукт, предназначенный для контроля роста корней у горшечных растений. Вторичные и боковые корни разрастаются и разрастаются, в результате чего корневая система становится плотной и здоровой. Он продавался под названием Spin Out, которое впервые было предложено Griffin LLC. Права на него теперь принадлежат SePRO Corp. Теперь он продается как Microkote либо в растворе, который вы применяете самостоятельно, либо в виде обработанных горшков.
Прочие гидроксиды меди (II)

Вместе с другими компонентами гидроксиды меди (II) многочисленны. Некоторые минералы, содержащие медь (II), содержат гидроксид. Известные примеры включают азурит , малахит , антлерит и брошантит . Азурит (2CuCO 3 · Cu (OH) 2 ) и малахит (Cuco 3 · Cu (OH) 2 ) являются гидрокси- карбонаты , тогда как антлерита (CuSO 4 · 2Cu (ОН) 2 ) и брошантит (CuSO 4 · 3Cu (ОН) 2 ) являются гидрокси- сульфаты .
Были исследованы многие синтетические производные гидроксида меди (II).