Коннексин - Connexin
| Коннексин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
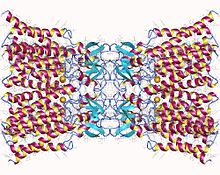 Додекамер коннексина-26. Щелевое соединение, состоящее из двенадцати идентичных белков коннексина, по шесть в мембране каждой клетки. Каждая из этих шести единиц представляет собой отдельный полипептид, который четыре раза проходит через мембрану (называемые четырехпроходными трансмембранными белками).
| |||||||||
| Идентификаторы | |||||||||
| Символ | Коннексин | ||||||||
| Pfam | PF00029 | ||||||||
| ИнтерПро | IPR013092 | ||||||||
| ПРОФИЛЬ | PDOC00341 | ||||||||
| TCDB | 1.A.24 | ||||||||
| OPM суперсемейство | 194 | ||||||||
| Белок OPM | 2zw3 | ||||||||
| |||||||||
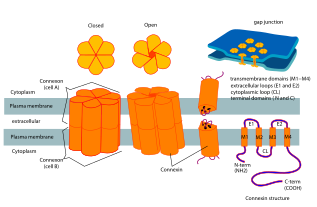
Коннексины ( Сх ) ( TC # 1.A.24 ), или белки щелевых соединений , являются структурно родственными трансмембранными белками, которые собираются с образованием щелевых соединений позвоночных. Совершенно другое семейство белков, иннексины , образуют щелевые контакты у беспозвоночных . Каждое щелевое соединение состоит из двух полуканалов или коннексонов , которые состоят из гомо- или гетерогексамерных массивов коннексинов, и коннексон в одной плазматической мембране стыкуется встык с коннексоном в мембране близко противоположной клетки. Гемиканал состоит из шести субъединиц коннексина, каждая из которых состоит из четырех трансмембранных сегментов. Щелевые соединения важны для многих физиологических процессов, таких как скоординированная деполяризация сердечной мышцы , правильное эмбриональное развитие и проводимая реакция в микрососудистой сети. По этой причине мутации в генах, кодирующих коннексин, могут приводить к функциональным нарушениям и аномалиям развития.
Номенклатура
Коннексины обычно называют в соответствии с их молекулярной массой, например, Cx26 - это белок коннексина 26 кДа. Конкурирующая номенклатура - это белковая система щелевых соединений , в которой коннексины сортируются по их α (GJA) и β (GJB) формам, а дополнительные коннексины сгруппированы в группы C, D и E, за которыми следует идентификационный номер, например, GJA1 соответствует Сх43. После голосования на конференции Gap Junction Conference (2007) в Эльсиноре сообщество согласилось использовать систему номенклатуры GJ для генов, кодирующих коннексины, но пожелало сохранить номенклатуру коннексинов для кодируемых белков, используя вес человеческого белка для нумерации. ортологичных белков.
Состав
Коннексины содержат четыре высокоупорядоченных трансмембранных сегмента (TMS), в первую очередь неструктурированные цитоплазматические концы C и N, цитоплазматическую петлю (CL) и две внеклеточные петли (EL-1) и (EL-2). Коннексины собираются в группы по шесть, чтобы сформировать полуканалы или коннексоны, а затем два полуканала объединяются, образуя щелевое соединение.
Доступна кристаллическая структура канала щелевого соединения, образованного Cx26 человека (также известного как GJB2) с разрешением 3,5 Å. Карта плотности показала два межмембранных полуканала и расположение четырех TMS шести протомеров, образующих каждый полуканал. Полуканалы имеют положительно заряженный вход в цитоплазму, воронку, отрицательно заряженный трансмембранный путь и внеклеточную полость. Пора сужается у воронки, которая образована шестью аминоконцевыми спиралями, выстилающими стенку канала, что, таким образом, определяет ограничение размера молекулы на входе в канал.
Семейство генов коннексина разнообразно: двадцать один идентифицированный член в секвенированном геноме человека и двадцать у мыши (девятнадцать из которых являются ортологичными парами). Обычно они весят от 25 до 60 кДа и имеют среднюю длину 380 аминокислот. Было обнаружено, что различные коннексины объединяются как в гомомерные, так и в гетеромерные щелевые переходы, каждый из которых может проявлять различные функциональные свойства, включая проводимость пор, избирательность по размеру, селективность заряда, стробирование напряжения и химическое стробирование.
Биосинтез и интернализация
Замечательный аспект коннексинов заключается в том, что у них относительно короткий период полураспада, составляющий всего несколько часов. Результатом является наличие динамического цикла, в котором синтезируются и заменяются коннексины. Было высказано предположение, что такая короткая продолжительность жизни позволяет более точно регулировать физиологические процессы, например, в миометрии .
От ядра к мембране
Поскольку они транслируются рибосомами, коннексины встраиваются в мембрану эндоплазматического ретикулума (ER). Именно в ER коннексины правильно складываются, образуя две внеклеточные петли, EL-1 и EL-2. Также в ER начинается олигомеризация молекул коннексина в полуканалы, процесс, который может продолжаться и в промежуточном компартменте UR-Golgi. Расположение этих полуканалов может быть гомотипическим, гетеротипическим и комбинированным гетеротипическим / гетеромерным. После выхода из ER и прохождения через ERGIC свернутые коннексины обычно попадают в цис- сеть Гольджи. Однако некоторые коннексины, такие как Cx26, могут транспортироваться независимо от Гольджи.
Сборка щелевого соединения
После внедрения в плазматическую мембрану клетки полуканалы свободно диффундируют в липидном бислое. С помощью специфических белков, в основном кадгеринов , полуканалы могут стыковаться с полуканалами соседних клеток, образуя щелевые соединения. Недавние исследования показали существование связи между адгезивными и щелевыми соединениями, что свидетельствует о более высоком уровне координации, чем считалось ранее.
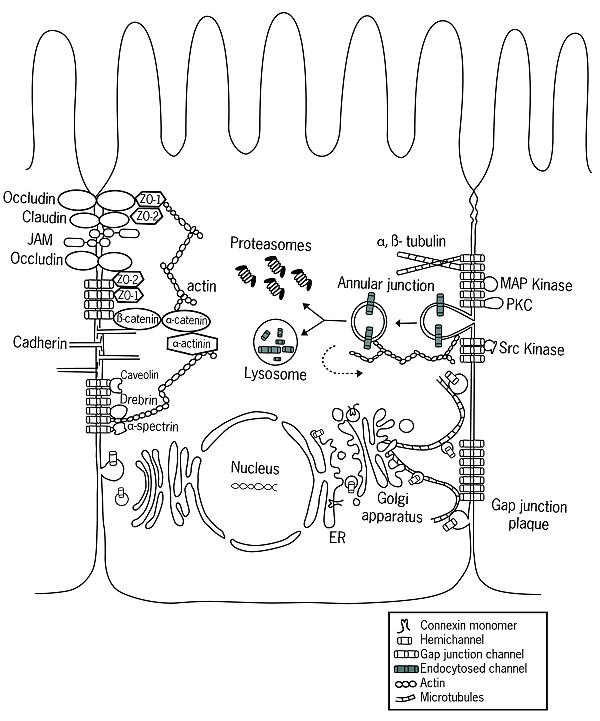
Функция
Щелевые соединения коннексина обнаруживаются только у позвоночных , тогда как функционально аналогичная (но генетически неродственная) группа белков, innexins , ответственна за щелевые соединения у беспозвоночных . Ортологи Innexin также были идентифицированы у Chordates , но они больше не способны образовывать щелевые соединения. Вместо этого каналы, образованные этими белками (называемыми паннексинами ), действуют как очень большие трансмембранные поры, которые соединяют внутри- и внеклеточные компартменты.
Внутри ЦНС щелевые контакты обеспечивают электрическую связь между клетками-предшественниками, нейронами и глиальными клетками. Исследования показали, что с использованием мышей с определенным нокаутом коннексина , связывание клеток имеет важное значение для передачи визуальных сигналов. В сетчатке окружающий свет влияет на сцепление клеток, обеспечиваемое каналами щелевого соединения, адаптируя зрительную функцию к различным условиям освещения. Сцепление клеток регулируется несколькими механизмами, включая экспрессию коннексина.
Decrock et al. . обсудили многоуровневую платформу, с помощью которой коннексины и паннексины могут влиять на следующие клеточные функции в ткани: (1) щелевые соединительные каналы коннексина (GJC) обеспечивают прямую межклеточную коммуникацию малых молекул, (2) гемиканалы коннексина и каналы паннексина могут вносить свой вклад. к аутокринным / паракринным сигнальным путям и (3) различные структурные домены этих белков обеспечивают независимые от каналов функции, такие как межклеточная адгезия , взаимодействия с цитоскелетом и активация внутриклеточных сигнальных путей. Таким образом, коннексины и паннексины вносят многогранный вклад в развитие мозга и специфические процессы в нейроглио-сосудистой единице, включая синаптическую передачу и пластичность, передачу глиальных сигналов, вазомоторный контроль и целостность гематоэнцефалического барьера в зрелой ЦНС.
Специфичность субстрата
Различные коннексины могут проявлять разные специфичности в отношении растворенных веществ. Например, аденозин примерно в 12 раз лучше проходил через каналы, образованные Cx32, тогда как AMP и ADP проходили примерно в 8 раз лучше, а АТФ более чем в 300 раз лучше через каналы, образованные Cx43. Таким образом, добавление фосфата к аденозину, по-видимому, смещает его относительную проницаемость с каналов, образованных Cx32, на каналы, образованные Cx43. Это может иметь функциональные последствия, поскольку энергетический статус клетки может контролироваться посредством экспрессии коннексина и образования каналов.
Транспортная реакция
Транспортная реакция, катализируемая щелевыми контактами коннексина:
- Малые молекулы (цитоплазма клетки 1) ⇌ малые молекулы (цитоплазма клетки 2)
Коннексины человека и их влияние на болезнь
| Коннексин | Ген | Расположение и функции |
|---|---|---|
| Сх43 | GJA1 | Экспрессируется на поверхности сосудистой сети атеросклеротической бляшкой и активируется во время атеросклероза у мышей. Может иметь патологические эффекты. Также экспрессируется между клетками гранулезы , что необходимо для пролиферации. Обычно экспрессируется в астроцитах, также обнаруживается в большинстве астроцитом человека и в астроглиальном компоненте глионейрональных опухолей. Он также является основным сердечным коннексином, обнаруживаемым в основном в миокарде желудочков. Связан с окулодентодигитальной дисплазией . |
| Сх46 | GJA3 | |
| Сх37 | GJA4 | Индуцируется в гладких мышцах сосудов во время коронарного артериогенеза. Мутации Сх37 не смертельны. Образует щелевые контакты между ооцитами и клетками гранулезы и необходимы для выживания ооцитов. |
| Сх40 | GJA5 | Избирательно экспрессируется в миоцитах предсердий. Отвечает за скоординированную электрическую активацию предсердий. |
| Сх33 |
GJA6 (GJA6P) |
Псевдоген у человека |
| Сх50 | GJA8 | Щелевые соединения между горизонтальными клетками А-типа в сетчатке мыши и кролика |
| Сх59 | GJA10 | |
| Сх62 | GJA10 | Cx62 человека соответствует Cx57 (мышь). Расположение в несущей аксон горизонтальной клетке B-типа в сетчатке кролика |
| Сх32 | GJB1 | Основной компонент периферического миелина. Мутации в человеческом гене вызывают Х-сцепленную болезнь Шарко-Мари-Тута , наследственную невропатию. В нормальном мозге человека CX32 экспрессируется в нейронах и олигодендроцитах. |
| Сх26 | GJB2 | Мутировал по синдрому Фохвинкеля, а также по синдрому кератита-иктиоза-глухоты (KID) . |
| Сх31 | GJB3 | Может быть связан с вариабильной эритрокератодермией . |
| Сх30.3 | GJB4 | Fonseca et al. подтвердил экспрессию Cx30.3 в тимоцитах . Может быть связан с вариабильной эритрокератодермией. |
| Сх31.1 | GJB5 | |
| Сх30 | GJB6 | Мутировал по синдрому Клустона (гидротическая эктодермальная дисплазия) |
| Сх25 | GJB7 | |
| Сх45 | GJC1 / GJA7 | Эпителиальные клетки протоков поджелудочной железы человека. Атриовентрикулярный узел. |
| Сх47 | GJC2 / GJA12 | Экспрессируется в щелевых соединениях олигодентроцитов |
| Сх31.3 | GJC3 | Человеческий ортолог мышиного Сх29. Не известно об образовании щелевых контактов. |
| Cx36 | GJD2 / GJA9 | Функция бета-клеток поджелудочной железы, опосредующая высвобождение инсулина. Нейроны во всей центральной нервной системе, где они синхронизируют нервную активность. |
| Сх31.9 | GJD3 / GJC1 | |
| Сх39 | GJD4 | |
| Сх40.1 | GJD4 | |
| Сх23 | GJE1 |
Щелевые соединения важны для многих физиологических процессов, таких как скоординированная деполяризация сердечной мышцы , правильное эмбриональное развитие и проводимая реакция в микрососудистой сети. По этой причине делеция или мутация различных изоформ коннексина вызывает отличительные фенотипы и патологии. В то время как мутации в Cx43 в основном связаны с окулодентодигитальной дисплазией, мутации Cx47 связаны с болезнью, подобной Pelizaeus-Merzbacher, и лимфедемой. Мутации Cx40 в основном связаны с фибрилляцией предсердий. Мутации в Cx37 еще не описаны, но полиморфизмы в гене Cx37 участвуют в развитии артериальных заболеваний.
Рекомендации
Внешние ссылки
-
 СМИ, связанные с коннексинами, на Викискладе?
СМИ, связанные с коннексинами, на Викискладе? - Коннексины в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
На момент редактирования в этой статье используется контент из "1.A.24 Семейство коннексинов, образующих разрывное соединение" , которое лицензировано таким образом, чтобы разрешить повторное использование в соответствии с непортированной лицензией Creative Commons Attribution-ShareAlike 3.0 , но не под GFDL . Все соответствующие условия должны быть соблюдены.