Костный сиалопротеин - Bone sialoprotein
Костный сиалопротеин (BSP) - это компонент минерализованных тканей, таких как кость , дентин , цемент и кальцинированный хрящ . BSP является важным компонентом внеклеточного матрикса кости и, как предполагается, составляет примерно 8% всех неколлагеновых белков, обнаруженных в кости и цементе. BSP, белок SIBLING , был первоначально выделен из кортикальной кости крупного рогатого скота в виде гликопептида массой 23 кДа с высоким содержанием сиаловой кислоты .
Вариант человеческого БСПА называется костью сиалопротеином 2 также известной как клеточно-связывающий сиалопротеин или интегриным-связывающего сиалопротеин и кодируется IBSP ген .
Состав
Нативный BSP имеет кажущуюся молекулярную массу 60-80 кДа на основе SDS-PAGE , что является значительным отклонением от прогнозируемой массы (на основе последовательности кДНК ) примерно 33 кДа. КДНК BSP млекопитающих кодируют белки, содержащие в среднем 317 аминокислот, которые включают секреторный сигнальный пептид из 16 остатков. Среди кДНК млекопитающих, охарактеризованных в настоящее время, существует примерно 45% сохранения идентичности последовательностей и еще 10-23% консервативных замен. Белок очень кислый (pKa ~ 3,9) и содержит большое количество остатков Glu, составляющих ~ 22% от общего количества аминокислот.
Прогнозирование вторичной структуры и анализ гидрофобности позволяют предположить, что первичная последовательность BSP имеет открытую гибкую структуру с потенциалом для образования областей α-спирали и некоторого β-слоя . Однако большинство исследований показали, что BSP не имеет α-спиральной или β-листовой структуры с помощью 1D ЯМР и кругового дихроизма. Анализ нативного белка с помощью электронной микроскопии подтверждает, что белок имеет протяженную структуру длиной примерно 40 нм. Эта гибкая конформация предполагает, что белок имеет несколько структурных доменов, однако было высказано предположение, что может существовать несколько пространственно сегментированных функциональных доменов, включая гидрофобный коллаген- связывающий домен ( остатки 36-57 rattus norvegicus ), нуклеирующую область гидроксиапатита смежной глутаминовой кислоты. кислотные остатки ( остатки 78-85, 155-164 rattus norvegicus ) и классический интегрин-связывающий мотив (RGD) около С-конца ( остатки 288-291 rattus norvegicus ).
Было продемонстрировано, что BSP подвергается обширной посттрансляционной модификации с углеводами и другими модификациями, составляющими приблизительно 50% молекулярной массы нативного белка. Эти модификации, которые включают N- и O-связанное гликозилирование , тирозин сульфатирование и серин и треонин фосфорилирование , делает этот белок весьма неоднороден.
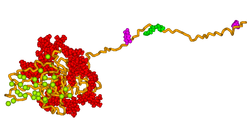
Трехмерная модель костного сиалопротеина человека была разработана с использованием методов молекулярного моделирования, как показано на рисунке выше. Модель предполагает, что белок обеспечивает гибкий шаблон для быстрой самосборки ионов кальция и фосфата, таким образом зародыша роста кристаллов гидроксиапатита.
Функция
Количество BSP в кости и дентине примерно одинаково, однако функция BSP в этих минерализованных тканях неизвестна. Одна из возможностей состоит в том, что BSP действует как ядро для образования первых кристаллов апатита . Поскольку апатит формируется вдоль коллагеновых волокон во внеклеточном матриксе, BSP может помочь направить, перенаправить или подавить рост кристаллов.
Дополнительными функциями BSP являются ангиогенез и защита от лизиса клеток, опосредованного комплементом. Регуляция гена BSP важна для минерализации костного матрикса и роста опухоли в кости.
использованная литература
внешние ссылки
- Человек IBSP место генома и IBSP ген подробно страницу в браузере УСК генома .
дальнейшее чтение
- Карадаг А., Фишер Л. В. (2006). «Костный сиалопротеин усиливает миграцию стромальных клеток костного мозга через матрицы, связывая MMP-2 с альфа (v) бета3-интегрином» . J. Bone Miner. Res . 21 (10): 1627–36. DOI : 10,1359 / jbmr.060710 . PMID 16995818 . S2CID 84886034 .
- Барнс Г.Л., Джавед А., Уоллер С.М. и др. (2003). «Связанные с остеобластами факторы транскрипции Runx2 (Cbfa1 / AML3) и MSX2 опосредуют экспрессию костного сиалопротеина в метастатических клетках рака молочной железы человека». Cancer Res . 63 (10): 2631–7. PMID 12750290 .
- Карлинфанте Г., Вассилиу Д., Свенссон О. и др. (2003). «Дифференциальная экспрессия остеопонтина и костного сиалопротеина в костных метастазах рака груди и простаты». Clin. Exp. Метастаз . 20 (5): 437–44. DOI : 10,1023 / A: 1025419708343 . PMID 14524533 . S2CID 341938 .
- Hwang Q, Cheifetz S, Total CM, et al. (2009). «Костный сиалопротеин не взаимодействует с прогелатиназой А (MMP-2) и не опосредует активацию MMP-2» . BMC Рак . 9 : 121. DOI : 10.1186 / 1471-2407-9-121 . PMC 2679042 . PMID 19386107 .
- Стиркарсдоттир У., Халлдорссон Б.В., Гретарсдоттир С. и др. (2009). «Новые варианты последовательности, связанные с минеральной плотностью кости». Nat. Genet . 41 (1): 15–7. DOI : 10.1038 / ng.284 . PMID 19079262 . S2CID 9876454 .
- Чжан Л., Хоу Х, Лу С. и др. (2010). «Прогностическое значение костного сиалопротеина и остеопонтина для метастазов в кости у пациентов с удаленным китайским немелкоклеточным раком легкого: большое когортное ретроспективное исследование». Рак легких . 67 (1): 114–9. DOI : 10.1016 / j.lungcan.2009.03.017 . PMID 19376608 .
- Рока Х., Фимфилаи М., Гопалакришнан Р. и др. (2005). «Кооперативные взаимодействия между RUNX2 и сайтами связывания гомеодоменного белка являются критическими для остеобласт-специфической экспрессии гена костного сиалопротеина» . J. Biol. Chem . 280 (35): 30845–55. DOI : 10.1074 / jbc.M503942200 . PMID 16000302 .
- Ламур В., Детри С., Санчес С. и др. (2007). «Репрессия, опосредованная Runx2 и гистондеацетилазой 3, облегчается при дифференцировке клеток остеобластов человека, что обеспечивает высокую экспрессию костного сиалопротеина» . J. Biol. Chem . 282 (50): 36240–9. DOI : 10.1074 / jbc.M705833200 . PMID 17956871 .
- Огата Ю. (2008). «Костный сиалопротеин и его механизм регуляции транскрипции». Журнал исследований пародонта . 43 (2): 127–35. DOI : 10.1111 / j.1600-0765.2007.01014.x . PMID 18302613 .
- Папотти М., Калебич Т., Воланте М. и др. (2006). «Костный сиалопротеин позволяет прогнозировать метастазы в кости при резектабельном немелкоклеточном раке легкого: ретроспективное исследование случай-контроль». J. Clin. Онкол . 24 (30): 4818–24. DOI : 10.1200 / JCO.2006.06.1952 . PMID 17050866 .
- Франк О, Хайм М., Якоб М. и др. (2002). «Количественный анализ RT-PCR в реальном времени стромальных клеток костного мозга человека во время остеогенной дифференцировки in vitro». J. Cell. Biochem . 85 (4): 737–46. DOI : 10.1002 / jcb.10174 . PMID 11968014 . S2CID 23595289 .
- Йергес Л. М., Клей Л., Каули Дж. А. и др. (2009). «Исследование ассоциации с высокой плотностью 383 генов-кандидатов на объемную МПК шейки бедра и поясничного отдела позвоночника среди пожилых мужчин» . J. Bone Miner. Res . 24 (12): 2039–49. DOI : 10,1359 / jbmr.090524 . PMC 2791518 . PMID 19453261 .
- Гордон Дж. А., Содек Дж., Хантер Г. К., Голдберг HA (2009). «Костный сиалопротеин стимулирует фокальные сигнальные пути, связанные с адгезией: роль в миграции и выживании клеток рака груди и простаты». J. Cell. Biochem . 107 (6): 1118–28. DOI : 10.1002 / jcb.22211 . PMID 19492334 . S2CID 36937586 .
- Араки С., Мезава М., Сасаки Ю. и др. (2009). «Регулирование транскрипции гена сиалопротеина кости человека паратироидным гормоном опосредуется двумя элементами ответа цАМФ». J. Cell. Biochem . 106 (4): 618–25. DOI : 10.1002 / jcb.22039 . PMID 19127545 . S2CID 5586385 .
- Wuttke M, Müller S, Nitsche DP, Paulsson M, Hanisch FG, Maurer P (сентябрь 2001 г.). «Структурная характеристика человеческого рекомбинантного и костного сиалопротеина. Функциональные последствия для прикрепления клеток и связывания гидроксиапатита» . J. Biol. Chem . 276 (39): 36839–48. DOI : 10.1074 / jbc.M105689200 . PMID 11459848 .
- Хилбиг Х., Винер Т., Армбрустер Ф. П. и др. (2005). «Влияние поверхностей дентальных имплантатов на экспрессию костного сиалопротеина в клетках, полученных из кости нижней челюсти человека». Med. Sci. Монит . 11 (4): BR111–5. PMID 15795688 .
- Коллер Д.Л., Итикава С., Лай Д. и др. (2010). «Общегеномное исследование минеральной плотности костной ткани у европейско-американских женщин в пременопаузе и репликации у афроамериканских женщин» . J. Clin. Эндокринол. Метаб . 95 (4): 1802–1809. DOI : 10.1210 / jc.2009-1903 . PMC 2853986 . PMID 20164292 .
- Strausberg RL, Feingold EA, Grouse LH, et al. (2002). «Создание и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши» . Proc. Natl. Акад. Sci. США . 99 (26): 16899–903. Bibcode : 2002PNAS ... 9916899M . DOI : 10.1073 / pnas.242603899 . PMC 139241 . PMID 12477932 .
- Фудзисава Р. (2002). «[Последние достижения в исследованиях белков костного матрикса]». Ниппон Риншо . 60 Дополнение 3: 72–8. PMID 11979972 .
- Лойбл С., Кенигс А., Кауфманн М., Коста С.Д., Бишофф Дж. (Декабрь 2006 г.). «[PTHrP и костный сиалопротеин как прогностические маркеры развития метастазов в кости у пациентов с раком груди]». Zentralbl Gynakol (на немецком языке). 128 (6): 330–5. DOI : 10,1055 / с-2006-942314 . PMID 17213971 .
- Уччелло М., Малагуарнера Дж., Ваканте М. и др. (2011). «Уровни сывороточного сиалопротеина в костях и метастазы в кости» . J. Cancer Res. Ther . 7 (2): 115–9. DOI : 10.4103 / 0973-1482.82912 . PMID 21768695 .