Треонин-аммиак-лиаза - Threonine ammonia-lyase
| L-треонин-аммиак-лиаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Трехмерное мультяшное изображение тетрамера треониндезаминазы
| |||||||||
| Идентификаторы | |||||||||
| ЕС нет. | 4.3.1.19 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
Треонинаммиаклиаза , также обычно называемая треониндезаминазой или треониндегидратазой , представляет собой фермент, ответственный за катализирование превращения L-треонина в альфа-кетобутират и аммиак . Альфа-кетобутират может быть преобразован в L-изолейцин , поэтому треонин-аммиак-лиаза функционирует как ключевой фермент в синтезе BCAA . В нем используется кофактор пиридоксаль-5'-фосфата , аналогичный многим ферментам, участвующим в метаболизме аминокислот . Он содержится в бактериях , дрожжах и растениях , хотя большинство исследований на сегодняшний день сосредоточено на формах этого фермента в бактериях. Этот фермент был одним из первых, в котором непосредственно наблюдали и изучали ингибирование отрицательной обратной связью конечным продуктом метаболического пути . Фермент служит прекрасным примером регуляторных стратегий, используемых в гомеостазе аминокислот .
Состав
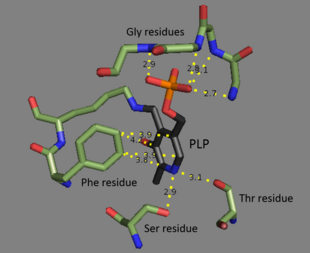
Треонин-аммиаклиаза представляет собой тетрамер идентичных субъединиц и расположен в виде димера димеров. Каждая субъединица имеет два домена : домен, содержащий каталитический активный сайт, и домен с аллостерическими регуляторными сайтами. Было показано, что эти две области представляют собой разные области, но регуляторный сайт одной субъединицы фактически взаимодействует с каталитическим сайтом другой субъединицы. Оба домена содержат повторяющийся структурный мотив бета-листов, окруженных альфа-спиралями . Хотя сайт связывания треонина до конца не изучен, структурные исследования действительно показывают, как связывается пиридоксальфосфатный кофактор. Кофактор PLP связан с остатком лизина посредством основания Шиффа , а фосфатная группа PLP удерживается на месте аминогруппами, происходящими из повторяющейся последовательности остатков глицина . Ароматическое кольцо связывается с фенилаланина , и азот на кольце водорода , связанный с гидроксильными содержащего группу остатков.
Механизм
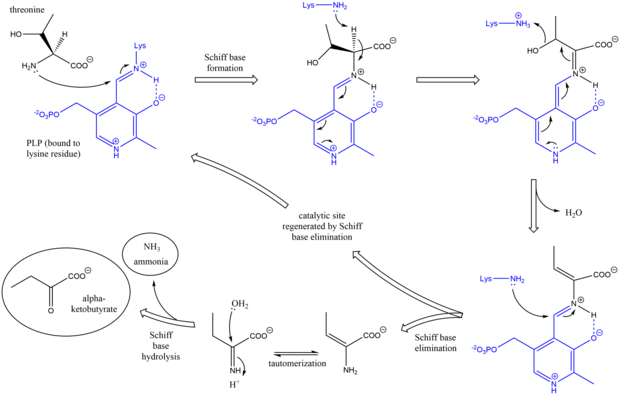
Механизм треонинаммиаклиазы аналогичен другим дезаминирующим ферментам PLP при использовании промежуточных продуктов основания Шиффа . Первоначально аминогруппа треонина атакует основание Шиффа лизин / PLP, вытесняя лизин. После того, как депротонирования аминокислоты альфа - углерода и последующей дегидратации (отсюда общее название треонин дегидратазы ), формируется новая основание Шиффа. Это основание Шифф заменено лизин атаки, реформинг каталитический активный PLP и отпускание первоначального алкена отработанного продукта. Этот продукт таутомеризуется , и после гидролиза основания Шиффа образуются конечные продукты. После образования конечного продукта альфа-кетобутирата изолейцин синтезируется путем прохождения через промежуточные продукты альфа-ацетогидроксибутирата до альфа-бета-дигидрокси-бета-метилвалерата, а затем до альфа-кето-бета-метилвалерата.
Регулирование
Было показано, что треонин-аммиак-лиаза не следует кинетике Михаэлиса-Ментен , скорее, она подлежит сложному аллостерическому контролю. Фермент ингибируется изолейцином, продуктом пути, в котором он участвует, и активируется валином , продуктом параллельного пути. Таким образом, увеличение концентрации изолейцина останавливает его производство, а увеличение концентрации валина отвлекает исходный материал (гидроксиэтил- ТФФ ) от производства валина. Фермент имеет два сайта связывания изолейцина; один имеет высокое сродство к изолейцину, а другой - низкое. Связывание изолейцина с сайтом с высоким сродством увеличивает сродство связывания с сайтом с низким сродством, и дезактивация фермента происходит, когда изолейцин связывается с сайтом с низким сродством. Валин усиливает ферментативную активность за счет конкурентного связывания с сайтом с высоким сродством, предотвращая ингибирующее действие изолейцина. Комбинация этих двух методов обратной связи уравновешивает концентрацию BCAA.
Изоформы и другие функции
Множественные формы треонин-аммиак-лиазы наблюдались у различных видов организмов. В Escherichia coli , системе, в которой фермент был тщательно изучен, обнаружены две различные формы фермента. Один из них является биосинтетическим и имеет характеристики ферментов, представленных здесь, в то время как другой является деградирующим и функционирует для генерации углеродных фрагментов для производства энергии . Пара изоформ также наблюдалась у других бактерий. У многих бактерий биоразлагаемая изоформа фермента экспрессируется в анаэробных условиях и стимулируется цАМФ и треонином, тогда как биосинтетическая изоформа экспрессируется в аэробных условиях. Это позволяет бактериям уравновешивать запасы энергии и подавлять энергоемкие синтетические пути, когда энергии не хватает.
У растений треонинаммиаклиаза играет важную роль в защитных механизмах против травоядных животных и активируется в ответ на абиотический стресс . Адаптированная изоформа фермента с уникальными свойствами, отпугивающими травоядных, экспрессируется в листьях растений. Каталитический домен этой изоформы чрезвычайно устойчив к протеолизу , в то время как регуляторный домен легко деградирует, поэтому при попадании в организм другого организма способность фермента дезаминировать треонин не контролируется. Это расщепляет треонин до того, как травоядное животное сможет его поглотить, в результате чего травоядное животное лишится незаменимой аминокислоты . Исследования треонин-аммиаклиазы в растениях также предложили новые стратегии в разработке ГМО с повышенной питательной ценностью за счет увеличения содержания незаменимых аминокислот.
Были обнаружены другие, более экзотические формы фермента, которые чрезвычайно малы по размеру, но все же сохраняют все каталитические и регуляторные функции.
Эволюция
Существует пять основных типов складок для PLP-зависимых ферментов. Треонин-аммиаклиаза является членом семейства Fold типа II, также известного как семейство триптофансинтазы . Хотя треонин-аммиак-лиаза не обладает субстратным туннелированием, как триптофансинтаза, она обладает значительной консервативной гомологией . Треонинаммиаклиаза наиболее близка к сериндегидратазе , и обе обладают одним и тем же общим каталитическим механизмом. Фактически было показано, что треонинаммиаклиаза проявляет некоторую специфичность по отношению к серину и может превращать серин в пируват . Регуляторный домен треонинаммиаклиазы очень похож на регуляторный домен фосфоглицератдегидрогеназы . Все эти отношения демонстрируют, что треонинаммиаклиаза имеет тесные эволюционные связи с этими ферментами. Из-за степени консервативности структуры и последовательности ферментов, распознающих аминокислоты, вполне вероятно, что эволюционное разнообразие этих ферментов возникло в результате совмещения отдельных регуляторных и каталитических доменов различными способами.
Актуальность для человека
Треонин-аммиак-лиаза у человека не обнаруживается. Таким образом, это один из примеров того, почему люди не могут синтезировать все 20 протеиногенных аминокислот ; в этом конкретном случае люди не могут преобразовывать треонин в изолейцин и должны потреблять изолейцин с пищей. Фермент также изучался в прошлом как возможное средство подавления опухоли по ранее описанным причинам, поскольку он лишает опухолевые клетки незаменимой аминокислоты и убивает их, но это лечение не применялось.