Серин-O-ацетилтрансфераза - Serine O-acetyltransferase
| серин-O-ацетилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
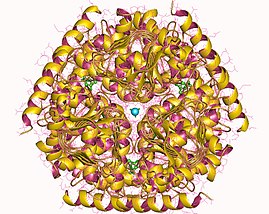 Гексамер серинацетилтрансферазы, Haemophilus influenzae
| |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.30 | ||||||||
| Количество CAS | 9023-16-9 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
В энзимологии , A серин O-ацетилтрансфераза ( EC 2.3.1.30 ) представляет собой фермент , который катализирует в химическую реакцию
- ацетил-КоА + L- серин- КоА + О- ацетил- L- серин
Таким образом, двумя субстратами этого фермента являются ацетил-КоА и L- серин , а двумя его продуктами являются КоА и О- ацетил- L- серин .
Этот фермент принадлежит к семейству трансфераз , в частности к тем ацилтрансферазам, переносящим группы, отличные от аминоацильных групп. Систематическое название данного фермента класс ацетил-СоА: L-серин О-ацетилтрансфераза . Другие имена в общем пользовании включают SATase , L-серин ацетилтрансферазу , серин ацетилтрансферазу и серин transacetylase . Этот фермент участвует в цистеин метаболизма и метаболизма серы .
Структурные исследования
По состоянию на конец 2007 г. было решено 7 структур для этого класса ферментов с кодами доступа PDB 1S80 , 1SSM , 1SSQ , 1SST , 1T3D , 1Y7L и 2ISQ .
N-концевой домен белка
| Концевой домен SATase N | |||||||||
|---|---|---|---|---|---|---|---|---|---|
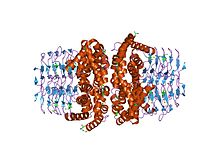 Структура фермента серинацетилтрансфераза-апофермент (усеченный)
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | SATase_N | ||||||||
| Pfam | PF06426 | ||||||||
| ИнтерПро | IPR010493 | ||||||||
| |||||||||
В молекулярной биологии , то домен белка SATase короток для серин ацетилтрансферазы и относится к ферменту , который катализирует превращение L -serine к L цистеина в E.coli , . Более конкретно, его роль в качестве катализатора активации L -serine с помощью ацетил-СоА записи .Этот относится к N-концу этого белка , который имеет последовательность , которая законсервированная в растениях и бактерий .
Важность функции
N-концевой домен протеина серинацетилтрансферазы помогает катализировать перенос ацетила . Этот конкретный фермент катализирует серин в цистеин, который в конечном итоге превращается в незаменимую аминокислоту метионин . Особый интерес для ученых представляет способность использовать естественную способность фермента серинацетилтрансферазы создавать незаменимые для питания аминокислоты и использовать эту способность через трансгенные растения . Эти трансгенные растения будут содержать больше незаменимых серных аминокислот, что означает более здоровую диету для людей и животных.
Структура
Амино-концевой альфа-спиральную домен особенно аминокислотных остатков His158 ( гистидин в положении 158) и Asp143 ( аспарагиновой кислоты в положении 143) образуют каталитическую триаду с подложкой для ацетил - передачи. Есть восемь альфа-спиралей, которые образуют N-концевой домен.
Рекомендации
- Кредич Н.М., Томкинс Г.М. (1966). «Ферментативный синтез L-цистеина в Escherichia coli и Salmonella typhimurium». J. Biol. Chem . 241 (21): 4955–65. PMID 5332668 .
- Смит И.К., Томпсон Дж.Ф. (1971). «Очистка и характеристика L-серин-трансацетилазы и O-ацетил-L-серинсульфгидрилазы из проростков фасоли (Phaseolus vulgaris)». Биохим. Биофиз. Acta . 227 (2): 288–95. DOI : 10.1016 / 0005-2744 (71) 90061-1 . PMID 5550822 .
| Эта статья о ферментах EC 2.3 является незавершенной . Вы можете помочь Википедии, расширив ее . |

