Ромбовидная протеаза - Rhomboid protease
| Ромбовидный | |||||||||
|---|---|---|---|---|---|---|---|---|---|
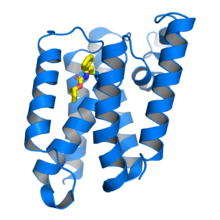
Ромбовидная протеаза GlpG Escherichia coli в комплексе сингибитором бета-лактама (желтый), связанным с каталитическимостатком серина . Из PDB : 3ZMH .
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Ромбовидный | ||||||||
| Pfam | PF01694 | ||||||||
| Клан пфам | CL0207 | ||||||||
| ИнтерПро | IPR002610 | ||||||||
| МЕРОПЫ | S54 | ||||||||
| SCOP2 | 144092 / СФЕРА / СУПФАМ | ||||||||
| OPM суперсемейство | 165 | ||||||||
| Белок OPM | 2ic8 | ||||||||
| |||||||||
В ромбовидных протеаз представляют собой семейство ферментов , которые существуют практически во всех видах. Это протеазы : они перерезают полипептидную цепь других белков. Это протеолитическое расщепление необратимо в клетках и является важным типом клеточной регуляции. Хотя протеазы являются одним из самых ранних и наиболее изученных классов ферментов, ромбоиды принадлежат к гораздо более недавно открытому типу: внутримембранным протеазам . Что уникально внутримембранных протеаз является то , что их активные участки захоронены в липидный бислой из клеточных мембран , и они расщепляют другие трансмембранных белков в пределах их трансмембранных доменов . Около 30% всех белков имеют трансмембранные домены, и их регулируемый процессинг часто имеет серьезные биологические последствия. Соответственно, ромбовидные тела регулируют многие важные клеточные процессы и могут быть вовлечены в широкий спектр заболеваний человека.
Интрамембранные протеазы
Ромбовидные тела - это внутримембранные сериновые протеазы . Другими типами внутримембранных протеаз являются аспартил- и металлопротеазы соответственно. Семейство пресенилинов и сигнальных пептидов, подобных пептидазе , которые представляют собой внутримембранные аспартил-протеазы, расщепляют субстраты, которые включают рецептор Notch и белок-предшественник амилоида , который участвует в болезни Альцгеймера . Семейство протеаз сайта 2 , которые представляют собой внутримембранные металлопротеиназы, регулируют, помимо прочего, биосинтез холестерина и стрессовые реакции у бактерий . Различные семейства внутримембранных протеаз эволюционно и механистически не связаны, но есть четкие общие функциональные темы, которые их связывают. Ромбовидные, пожалуй, наиболее охарактеризованный класс.
История
Ромбовидные были первые названы после того, как мутация в плодовой мушки дрозофилы , обнаруженная в известном генетическом скрининге , что привело к Нобелевской премии по Нюсляйн-Фольхард и Эрик Wieschaus . На этом скрининге они обнаружили несколько мутантов со схожими фенотипами: «заостренные» скелеты головы эмбриона. Они назвали каждого из них острым тематическим именем - одно из них было ромбовидным. Сначала это было замечено, потому что мутация нарушила развитие, позже генетический анализ доказал, что эта группа генов является членами сигнального пути рецептора эпидермального фактора роста (EGF) , и что ромбовидность необходима для генерации сигнала, активирующего рецептор EGF. Молекулярная функция ромбовидных тел потребовалось немного больше времени, чтобы раскрыть их, но сочетание генетики и молекулярных методов привело к открытию, что ромбовидные дрозофилы и другие члены этого семейства были первыми известными внутримембранными сериновыми протеазами.
Функция
Ромбоиды были впервые обнаружены как протеазы, которые регулируют передачу сигналов рецептора EGF у дрозофилы . Высвобождая внеклеточный домен фактора роста Spitz из его трансмембранного предшественника, ромбовидный запускает передачу сигналов. С тех пор были предложены многие другие важные биологические функции.
- Позже было показано, что ромбоид-1 дрозофилы регулирует сон посредством новой функции уже открытого механизма.
- Хотя это менее хорошо установлено, чем у Drosophila , есть некоторые доказательства того, что ромбовидные тела могут участвовать в передаче сигналов фактора роста у млекопитающих, включая человека. Они также участвуют в передаче сигналов эфрина , расщеплении антикоагулянтного белка тромбомодулина и заживлении ран .
- У всех эукариот есть митохондриальный ромб. У дрожжей это, как было показано, контролирует функцию и морфологию митохондрий, регулируя слияние мембран посредством расщепления динамин- подобной GTPase, называемой Mgm1p, ортолога человеческого OPA1 . У Drosophila митохондриальный ромбовидный (Rhomboid-7) также регулирует слияние митохондриальных мембран. Drosophila Opa1 и Rhomboid-7, по-видимому, имеют те же отношения, что и у дрожжей. У млекопитающих также нарушена функция митохондрий у мутантов PARL , митохондриального ромбовидного тела , но диапазон функций более сложен. PARL регулирует ремоделирование митохондриальных крист , участвует в гибели клеток и метаболизме , и появляется все больше доказательств его важной роли в болезни Паркинсона ;
- Апикомплексные паразиты (включая Plasmodium , возбудителя малярии и токсоплазмы ) используются для перемещения ромбовидных тел между прикреплением к клетке-мишени и проникновением, и большинство адгезинов, продуцируемых микронемами , высвобождаются из микронемы с помощью ромбовидных образований. Ромбовидные формы также вовлечены в патогенность других паразитов. В частности, в Toxoplasma некоторые серпины подавляют ромбовидные формы.
- Ромбовидный элемент у грамотрицательной бактерии Providencia stuartii необходим для функционирования механизма транслокации белков аргинина (ТАТ).
- Ромбовидные формы контролируют передачу сигналов рецептора EGF у Caenorhabditis elegans, как и у Drosophila .
Состав
Ромбоиды были первыми внутримембранными протеазами, для которых была решена кристаллическая структура с высоким разрешением . Эти структуры подтвердили предсказания, что ромбоиды имеют ядро из шести трансмембранных доменов и что каталитический сайт зависит от каталитической диады серина и гистидина. Структуры также объяснили, как протеолитическая реакция, для которой требуются молекулы воды, может происходить в гидрофобной среде липидного бислоя: одна из центральных загадок внутримембранных протеаз. Активный центр ромбовидной протеазы находится в гидрофильном углублении, в принципе доступном для воды из основного раствора. Однако было высказано предположение, что может существовать вспомогательный механизм для облегчения доступа молекул воды к каталитической диаде в нижней части активного центра для обеспечения каталитической эффективности.
Активный центр ромбовидной протеазы защищен латерально от липидного бислоя шестью составляющими его трансмембранными спиралями, что позволяет предположить, что доступ субстрата к активному центру ромбовидной железы регулируется. Одной из областей неопределенности был путь доступа к субстрату . Первоначально предлагалось вводить субстраты между трансмембранными сегментами (TMS) 1 и 3, но имеющиеся данные убедительно подтверждают наличие альтернативной точки доступа между TMS 2 и 5. Это мнение также подтверждается тем фактом, что мутации в TMS 5 имеют только маргинальный эффект. на термодинамическую стабильность ромбоида, в отличие от других участков молекулы. Совсем недавно первая в истории сокристаллическая структура внутримембранной протеазы - версия ромбовидной протеазы GlpG от Escherichia coli - и пептид, полученный из субстрата, связанный в активном сайте, подтверждает и расширяет эту модель доступа к субстрату и обеспечивает последствия для механизма других белков ромбовидного суперсемейства. GlpG E. coli необычен своей низкой аффинностью связывания фермента / субстрата . Однако детали того, как субстрат TMS может распознаваться ромбовидной структурой, все еще неясны. Некоторые авторы предполагают, что доступ к субстрату включает большое латеральное смещение TMS 5, чтобы открыть сердцевину ромбовидной кости. В других сообщениях вместо этого предполагается, что большое латеральное движение TMS 5 не требуется, и предполагается, что поверхность TMS 2 и 5 скорее служит «внутримембранным экзосайтом», опосредующим распознавание субстрата TMS. Ортолог ромбовидной формы у D. suzukii - Dsuz \ DS10_00004507.
Ферментативная специфичность
Ромбовидные клетки не расщепляют все трансмембранные домены. На самом деле они очень специфичны, с ограниченным количеством субстратов. Большинство известных к настоящему времени природных ромбовидных субстратов представляют собой белки с одним трансмембранным доменом типа 1, амино-концы которых находятся в просвете / внеклеточном компартменте. Однако недавние исследования показали, что мембранный белок 2 типа (т.е. с противоположной топологией: аминоконце является цитоплазматическим) или даже многопроходные мембранные белки могут действовать как ромбовидные субстраты. Специфика ромбов лежит в основе их способности контролировать функции в широком диапазоне биологических процессов и, в свою очередь, понимание того, что делает конкретный трансмембранный домен ромбовидным субстратом, может пролить свет на функцию ромбовидной формы в различных контекстах.
Первоначальная работа показала, что ромбовидные формы распознают нестабильность трансмембранной альфа-спирали в месте расщепления в качестве основной детерминанты субстрата. Совсем недавно было обнаружено, что ромбовидные субстраты определяются двумя отдельными элементами: трансмембранным доменом и мотивом первичной последовательности в нем или непосредственно рядом с ним. Этот мотив узнавания определяет место расщепления субстрата, которое может происходить как внутри, так и вне трансмембранного домена, в прилегающей к мембране области. В первом случае дестабилизирующие спираль остатки в субстрате TMS также необходимы для эффективного расщепления. Подробный анализ кинетики ферментов фактически показал, что взаимодействия мотива распознавания с активным центром ромбовидной формы определяют k cat расщепления субстрата. Принципы распознавания TMS субстрата с помощью ромбов остаются плохо изученными, но многочисленные доказательства указывают на то, что ромбоиды (и, возможно, также др. Внутримембранные протеазы ) каким-то образом распознают структурную гибкость или динамику трансмембранного домена своих субстратов. Полное понимание вовлеченных биофизических и структурных принципов потребует структурной характеристики комплекса ромбовидного с полным трансмембранным субстратом. В качестве первого шага к этой цели недавняя сокристаллическая структура фермента в комплексе с производным от субстрата пептидом, содержащим основанный на механизме ингибитор, объясняет наблюдаемые предпочтения последовательностей мотива распознавания в ромбовидных субстратах структурно и обеспечивает значительный прогресс в текущем понимание ромбовидной специфичности и механизма белков ромбовидного семейства.
У некоторых грамотрицательных бактерий, включая Shewanella и Vibrio , до тринадцати белков обнаруживаются с GlyGly-CTERM, C-концевым доменом гомологии, состоящим из богатого глицином мотива, высокогидрофобной трансмембранной спирали и кластера основных остатков. Этот домен, по-видимому, является последовательностью узнавания для ромбосортазы, ответвления семейства ромбовидных протеаз, ограниченного только бактериями с доменом GlyGly-CTERM.
Медицинское значение
Уже известно, что разнообразие биологических функций, зависящих от ромбовидных тел, отражено в доказательствах того, что ромбовидные тела играют роль в различных заболеваниях, включая рак , паразитарные инфекции и диабет . Однако важно отметить, что еще не установлено ни одного случая, когда точное медицинское значение было бы полностью подтверждено.
О препаратах, которые модулируют активность ромбовидной железы, еще не сообщалось, хотя недавнее исследование выявило низкомолекулярные ингибиторы, основанные на механизме, которые могут стать основой для разработки лекарств в будущем.
Ромбовидная семья
Ромбовидные протеазы, по-видимому, законсервированы у всех эукариот и подавляющего большинства прокариот . Биоинформатический анализ подчеркивает, что у некоторых членов семейства ромбовидных нет аминокислотных остатков, необходимых для протеолиза, что означает, что они не могут расщеплять субстраты. Эти «псевдопротеазы» включают подсемейство, названное iRhoms (также известное как RHBDF1 и RHBDF2 ). iRhoms может способствовать ER-ассоциированной деградации (ERAD) лигандов рецептора EGF у дрозофилы , тем самым обеспечивая механизм регуляции активности рецептора EGF в головном мозге. Это означает, что фундаментальный механизм контроля качества клеток используется многоклеточными организмами для регулирования передачи сигналов между клетками. У мышей iRhoms являются ключевыми шаперонами трафика, необходимыми для экспорта ADAM17 / TACE в ER и его созревания. Таким образом, iRhoms необходимы для передачи сигналов рецепторами TNF-альфа и EGF , что делает их очень привлекательными с медицинской точки зрения.
Филогенетический анализ показывает, что ромбоиды на самом деле являются членами более крупного ромбоподобного суперсемейства или клана, которое включает белки дерлина , также участвующие в ERAD.
Кинетопластиды имеют необычно небольшой репертуар ромбовидных семейств : у Trypanosoma brucei XP 001561764 и XP 001561544 , а у T. cruzi XP 805971 , XP 802860 и XP 821055 .
Различные ромбовидные белки семейства жизненно важны для токсоплазма вирулентности и моторики , в том числе TgMIC2 , TgMIC6 , различные AMA1 варианты , включая TgAMA1 , TgROM1 , TgROM4 и TgROM5 .
Митохондрии трипаносом содержат TimRhom I и TimRhom II (два члена семейства ромбовидных с деактивированной протеолитической функцией) в своих транслоказах, предшествующих последовательности . Трудность найти большее сходство либо с эукариотическими, либо с бактериальными родственниками может означать, что они пришли как часть первоначального митохондриального предшественника. Родственники ромбов могут быть мембранными транспортными белками в системах ERAD и SELMA .
iRhoms
iRhoms представляют собой ромбовидные белки, но не являются протеазами. Как и ромбовидные, они впервые были обнаружены у дрозофил . Однако, в отличие от ромбов, iRhoms ингибируют передачу сигналов EGFr. Мыши с нокаутом по iRhom2 имеют серьезную иммунную недостаточность.
использованная литература
дальнейшее чтение
внешние ссылки
- «Резюме для семейства S54 (семейство ромбовидных)» . МЕРОПЫ .
- «EC 3.4.21.105» . Expasy . SIB Швейцарский институт биоинформатики.
