Проинсулин - Proinsulin
| инсулин | |||||||
|---|---|---|---|---|---|---|---|
 Инсулин претерпевает обширную посттрансляционную модификацию по пути производства. Производство и секреция в значительной степени независимы; подготовленный инсулин хранится в ожидании секреции. И С-пептид, и зрелый инсулин являются биологически активными. Компоненты клеток и белки на этом изображении не в масштабе.
| |||||||
| Идентификаторы | |||||||
| Условное обозначение | INS | ||||||
| Ген NCBI | 3630 | ||||||
| HGNC | 6081 | ||||||
| OMIM | 176730 | ||||||
| RefSeq | NM_000207 | ||||||
| UniProt | P01308 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 11 п. 15,5 | ||||||
| |||||||
Проинсулина является прогормоном предшественником инсулина , достигнутый в бета - клетках этих островков Лангерганса , специализированные области в поджелудочной железе . В организме человека, проинсулина кодируется INS гена . Островки Лангерганса секретируют только от 1% до 3% проинсулина в неизмененном виде. Однако, поскольку у проинсулина более длительный период полураспада, чем у инсулина, он может составлять от 5 до 30% инсулиноподобных структур, циркулирующих в крови. Концентрация проинсулина выше после еды и ниже, когда человек постится. Кроме того, хотя проинсулин и инсулин имеют структурные различия, проинсулин действительно демонстрирует некоторое сродство к рецептору инсулина . Из-за относительного сходства в структуре проинсулин может производить от 5% до 10% метаболической активности, аналогично индуцируемой инсулином.
Проинсулин - это конечная одноцепочечная белковая структура, секретируемая клетками перед расщеплением на зрелый инсулин. Проинсулин был открыт профессором Дональдом Ф. Штайнером из Чикагского университета в 1967 году.
Состав
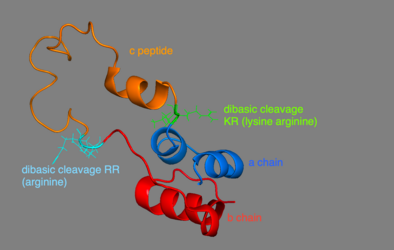
Проинсулин состоит из 86 остатков у людей (81 у коров) и состоит из трех различных цепей. Цепь А, цепь В и область, соединяющая их, называются С-пептидом . Правильная структура проинсулина имеет решающее значение для правильного сворачивания зрелого инсулина, поскольку размещение C-пептида настраивает молекулу для создания правильно расположенных дисульфидных связей внутри и между цепями A и B. Для правильной структуры зрелого инсулина необходимы три дисульфидные связи. Две из этих дисульфидных связей находятся между цепями A и B, а одна является связью внутри цепи A. Дисульфидные связи возникают между седьмыми остатками цепи А и В, 20 остатком цепи А и 19 остатком цепи В, а также 6-м и 11-м остатками цепи А.
Пептид C находится между цепями A и B проинсулина. Связь между A-цепью и C-пептидом намного более стабильна, чем соединение между C-пептидом и B-цепью, с альфа-спиральными особенностями, проявляющимися рядом с соединением C-пептид-A-цепь. Соединение цепи C-пептид-A происходит между остатками 64 и 65 проинсулина. Это молекулы лизина и аргинина соответственно. Связь C-пептид-B-цепь находится между двумя остатками аргинина в положениях 31 и 32 проинсулина.
Существует консервация большей части структуры проинсулина среди видов млекопитающих, при этом большая часть изменений остатков, наблюдаемых от одного вида к другому, присутствует в С-пептиде. Тем не менее, остатки С-пептида, которые являются консервативными для разных видов, взаимодействуют с аналогичным образом консервативными остатками в цепях A и B. Таким образом, предполагается, что эти консервативные остатки важны для функционирования зрелого инсулина.
Синтез и посттрансляционная модификация
Проинсулин синтезируется на связанных с мембранами рибосомах, обнаруженных на шероховатом эндоплазматическом ретикулуме , где он складывается, а его дисульфидные связи окисляются. Затем он транспортируется в аппарат Гольджи, где он упаковывается в секреторные пузырьки и где он обрабатывается серией протеаз с образованием зрелого инсулина . В зрелом инсулине на 35 аминокислот меньше; 4 полностью удаляются, а оставшийся 31 образует С-пептид . С-пептид извлекается из центра последовательности проинсулина; два других конца (цепь B и цепь A) остаются связанными дисульфидными связями.
Посттрансляционном модификации проинсулина в зрелые инсулин происходит только в бета - клетках островков Лангерганса. Когда проинсулин транспортируется через аппарат Гольджи, С-пептид расщепляется. Это расщепление происходит с помощью двух эндопротеаз. Эндопротеазы типа I , РС1 и РС3, разрушают связь С-пептид-В-цепь. РС2, эндопротеаза типа II, расщепляет связь цепи С-пептид-А. Полученная молекула, теперь уже зрелый инсулин, хранится в виде гексамера в секреторных везикулах и стабилизируется ионами до тех пор, пока не будет секретироваться.
Иммуногенность
Когда инсулин был первоначально очищен из поджелудочной железы крупного рогатого скота или свиньи , весь проинсулин не был удален полностью. Когда некоторые люди использовали эти инсулины, проинсулин мог вызвать реакцию организма, вызвавшую сыпь, сопротивление инсулину или даже образование вмятин или бугорков на коже в месте введения инсулина. Это можно охарактеризовать как ятрогенное повреждение из-за незначительных различий между проинсулином разных видов. С конца 1970-х годов, когда был введен высокоочищенный свиной инсулин, и уровень чистоты инсулина достиг 99%, это перестало быть серьезной клинической проблемой. Что касается их влияния на фармакокинетику инсулина, умеренные концентрации определенных антител к инсулину могут быть положительными для всех диабетиков без эндогенной секреции инсулина (например, людей с диабетом 1 типа ), поскольку связывающие инсулин антитела эффективно увеличивают скорость клиренса инсулина и пространство распределения и помогают для продления его фармакологического и биологического периода полураспада.
Медицинское значение
Исторически сложилось так, что в центре внимания многих метаболических заболеваний, связанных с инсулином, был зрелый инсулин. Однако в последние годы важность изучения структуры и функции проинсулина или соотношения проинсулин: инсулин в отношении этих заболеваний становится все более очевидной.
Сахарный диабет
Повышенные уровни проинсулина в системе кровообращения по сравнению с концентрациями зрелого инсулина могут указывать на приближающуюся инсулинорезистентность и развитие диабета 2 типа . Дополнительные проблемы с проинсулином, которые могут привести к диабету, включают мутации в количестве присутствующих цистеинов, которые могут повлиять на правильную укладку. Если мутация вызывает только легкие изменения, она может просто усилить способность эндоплазматического ретикулума правильно сворачивать белок. Этот стресс через некоторое время приведет к уменьшению количества β-клеток, продуцирующих зрелый инсулин, а затем приведет к сахарному диабету.
Неонатальный сахарный диабет
Постнатальный проинсулин имеет решающее значение для регуляции метаболизма. Однако проинсулин у новорожденных важен для нормального развития глазных нервов, сердца и общего выживания эмбриональных клеток. Регулирование концентрации проинсулина во время эмбрионального развития имеет решающее значение, поскольку слишком много или слишком мало пептида может вызвать дефекты и смерть плода. До сих пор при изучении сахарного диабета новорожденных только мутации с заменой аминокислот, обнаруженные в B-домене, приводили к заболеванию.
Смотрите также
- инсулин
- препроинсулин
- сигнальный пептид
- сигнальная пептидная пептидаза
- пропротеинконвертаза 1 (PC1)
- пропротеинконвертаза 2 (PC2)