Эксцизионная репарация нуклеотидов - Nucleotide excision repair
Эксцизионная репарация нуклеотидов - это механизм репарации ДНК . Повреждение ДНК происходит постоянно из-за химических веществ (например, интеркалирующих агентов ), радиации и других мутагенов . Существуют три пути эксцизионной репарации для восстановления повреждений одноцепочечной ДНК: эксцизионная репарация нуклеотидов (NER), эксцизионная репарация оснований (BER) и репарация ошибочного спаривания ДНК (MMR). Хотя путь BER может распознавать определенные негабаритные повреждения в ДНК, он может корректировать только поврежденные основания, которые удаляются конкретными гликозилазами . Точно так же путь MMR нацелен только на несовпадающие пары оснований Watson-Crick .
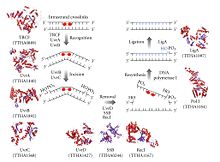
Эксцизионная репарация нуклеотидов (NER) является особенно важным механизмом эксцизии, который устраняет повреждения ДНК, вызванные ультрафиолетовым светом (УФ). Повреждение ДНК УФ-излучением приводит к образованию объемных аддуктов ДНК - эти аддукты в основном представляют собой димеры тимина и 6,4-фотопродукты. Распознавание повреждения приводит к удалению короткого одноцепочечного сегмента ДНК, содержащего повреждение. Неповрежденная одноцепочечная ДНК остается, и ДНК-полимераза использует ее в качестве матрицы для синтеза короткой комплементарной последовательности . Окончательное лигирование для завершения NER и образования двухцепочечной ДНК выполняется ДНК-лигазой . NER можно разделить на два подпути: глобальный геномный NER (GG-NER или GGR) и связанный с транскрипцией NER (TC-NER или TCR). Эти два подпути различаются тем, как они распознают повреждение ДНК, но имеют одинаковый процесс разреза, восстановления и лигирования поражения.
Важность NER подтверждается тяжелыми заболеваниями человека, которые возникают в результате врожденных генетических мутаций белков NER. Пигментная ксеродермия и синдром Кокейна - два примера заболеваний, связанных с НЭР.
У эукариот
Эксцизионная репарация нуклеотидов более сложна у эукариот, чем у прокариот , но общий принцип аналогичен. В NER в клетках млекопитающих участвуют 9 основных белков. Недостаток некоторых белков приводит к болезням; названия белков связаны с заболеванием. XPA , XPB , XPC , XPD, XPE , XPF и XPG все происходят от пигментной херодермы, а CSA и CSB представляют собой белки, связанные с синдромом Кокейна. Кроме того, белки ERCC1 , RPA , RAD23A , RAD23B и другие также участвуют в эксцизионной репарации нуклеотидов. Более полный список белков, участвующих в NER, приведен ниже .
Эукариотическую эксцизионную репарацию нуклеотидов можно разделить на два подпути: глобальный геномный NER (GG-NER) и связанный с транскрипцией NER (TC-NER). Три разных набора белков участвуют в распознавании повреждений ДНК для каждого подпути. После распознавания повреждений три подпути сходятся для этапов двойного разреза, восстановления и лигирования.
Распознавание повреждений
Глобальный геномный NER (GG-NER)
Глобальный геномный NER восстанавливает повреждения как транскрибируемых, так и нетранскрибируемых цепей ДНК в активных и неактивных генах по всему геному. Этот процесс не зависит от транскрипции. В этом пути задействованы несколько белков, «воспринимающих повреждение», в том числе связывающие повреждение ДНК (DDB) и комплексы XPC-Rad23B, которые постоянно сканируют геном и распознают искажения спирали: комплекс XPC -Rad23B отвечает за распознавание искажений, в то время как DDB1 и DDB2 ( XPE ) также может распознавать некоторые виды повреждений, вызванных УФ-светом. Кроме того, XPA выполняет функцию распознавания повреждений, которая пока еще плохо определена. После идентификации поврежденного участка последующие репарационные белки затем привлекаются к поврежденной ДНК для проверки наличия повреждения ДНК, вырезают поврежденную ДНК, окружающую поражение, затем заполняют репарационный пластырь.
Заболевания, связанные с GG-NER
Мутации в аппарате GG-NER ответственны за множественные генетические нарушения, включая:
- Пигментная ксеродермия (XP): серьезная светочувствительность, высокий уровень рака на участках тела, подверженных воздействию солнца (например, на коже)
Связанная с транскрипцией репарация (TC-NER)
В любой момент времени большая часть генома в организме не подвергается транскрипции; существует разница в эффективности NER между транскрипционно молчащими и транскрипционно активными областями генома. При многих типах повреждений NER восстанавливает транскрибируемые цепи транскрипционно активных генов быстрее, чем восстанавливает нетранскрибируемые цепи и транскрипционно молчащую ДНК.
TC-NER и GG-NER отличаются только начальными этапами распознавания повреждений ДНК. Принципиальное различие между TC-NER и GG-NER состоит в том, что TC-NER не требует белков XPC или DDB для распознавания искажений в клетках млекопитающих. Вместо этого TC-NER инициируется, когда РНК-полимераза останавливается на повреждении в ДНК: заблокированная РНК-полимераза служит сигналом распознавания повреждения, который заменяет потребность в свойствах распознавания искажения комплексов XPC-RAD23B и DDB. Белки CS (CSA и CSB) связывают некоторые типы повреждений ДНК вместо XPC-Rad23B.
Возможны и другие механизмы ремонта, но они менее точны и эффективны.
Заболевания, связанные с TC-NER
TC-NER инициируется, когда РНК-полимераза останавливается в повреждении ДНК, после чего белковые комплексы помогают перемещать полимеразу назад. Мутации в аппарате TC-NER ответственны за множественные генетические нарушения, включая:
- Трихотиодистрофия (TTD): некоторые люди светочувствительны, ихтиоз, умственная / физическая отсталость.
- Синдром Кокейна (CS): светочувствительность, умственная отсталость, прогерия , микроцефалия.
Двойной разрез
Фактор транскрипции II H (TFIIH) является ключевым ферментом, участвующим в двойном вырезании. TFIIH и XPG сначала привлекаются к участку повреждения ДНК (XPG стабилизирует TFIIH). Субъединицы TFIIH XPD и XPB действуют как 5'-3 'и 3'-5' геликаза соответственно - они помогают раскручивать ДНК и создавать соединение между двухцепочечной и одноцепочечной ДНК вокруг пузыря транскрипции . Помимо стабилизации TFIIH, XPG также обладает эндонуклеазной активностью; это сокращает повреждение ДНК на 3' стороне в то время как XPF - ERCC1 порезы Гетеродимерного белка на 5' стороны. Двойной разрез приводит к удалению оцДНК с одноцепочечным разрывом в 25-30 нуклеотидов. Небольшие, вырезанные, содержащие повреждения олигонуклеотиды ДНК (sedDNA) сначала высвобождаются из дуплекса в комплексе с TFIIH, но затем диссоциируют АТФ-зависимым образом и связываются с репликационным белком А (RPA). Ингибирование синтеза и лигирования ДНК, заполняющих пробелы, приводит к накоплению связанных с RPA седДНК в клетке.
Белок репликации A (RPA) и XPA - это два последних белка, связанных с основным комплексом репарации NER. Эти два белка присутствуют до связывания TFIIH, поскольку они участвуют в проверке повреждения ДНК. Они также могут защищать одноцепочечную ДНК. После проверки делается 5-дюймовый боковой разрез, и репарация ДНК начинается перед 3-дюймовым боковым разрезом. Это помогает уменьшить открытую одноцепочечную ДНК в процессе восстановления.
Ремонт и перевязка
Фактор репликации C ( RFC ) загружает ядерный антиген пролиферирующих клеток (PCNA) на цепь ДНК. Это позволяет ДНК-полимеразам, участвующим в репарации (δ, ε и / или κ), копировать неповрежденную цепь посредством транслокации. ДНК - лигазы I и закрылков эндонуклеазы 1 или комплекс лигазы-III-XRCC1 уплотнения ники к полному НЭК.
У прокариот: УФ-белки.
Процесс нуклеотидной эксцизионной репарации управляется в кишечных палочках самой UvrABC эндонуклеазы ферментного комплекса, который состоит из четырех белков UVR: UvrA, УФОК, UvrC и ДНК хеликазных II (иногда также известный как UvrD в этом комплексе). Сначала комплекс UvrA-UvrB сканирует ДНК, при этом субъединица UvrA распознает искажения спирали, вызванные, например, димерами пиримидина . Когда комплекс распознает такое искажение, субъединица UvrA уходит, и белок UvrC входит и связывается с мономером UvrB и, следовательно, образует новый димер UvrBC . UvrB расщепляет фосфодиэфирную связь на 4 нуклеотида ниже повреждения ДНК, а UvrC расщепляет фосфодиэфирную связь на 8 нуклеотидов выше повреждения ДНК и создает вырезанный сегмент из 12 нуклеотидов. Затем входит ДНК-геликаза II (иногда называемая UvrD) и удаляет вырезанный сегмент, активно разрывая водородные связи между комплементарными основаниями. Затем образовавшийся пробел заполняется с помощью ДНК-полимеразы I и ДНК-лигазы. Основной процесс удаления очень похож на высшие клетки, но эти клетки обычно включают намного больше белков - простой пример - кишечная палочка .
TC-NER также существует в бактериях и опосредуется белком TRCF (Mfd) . TRCF представляет собой SF2- АТФазу, которая использует гидролиз АТФ для транслокации на дцДНК выше пузыря транскрипции и прямой транслокации РНК-полимеразы, тем самым инициируя диссоциацию тройного элонгационного комплекса РНК-полимеразы. TRCF также задействует механизм эксцизионной репарации нуклеотидов Uvr (A) BC путем прямого физического взаимодействия с субъединицей UvrA.
Рак

Хотя исторические исследования показали противоречивые результаты, генетические вариации или мутации генов эксцизионной репарации нуклеотидов могут влиять на риск рака , влияя на эффективность репарации. Однонуклеотидные полиморфизмы (SNP) и несинонимичные кодирующие SNP (nsSNP) присутствуют в очень низких количествах (> 1%) в человеческой популяции. Если такие мутации находятся в генах NER или регуляторных последовательностях, они могут отрицательно повлиять на способность к репарации ДНК, что приведет к увеличению вероятности развития рака. Хотя функциональное влияние всех полиморфизмов не охарактеризовано, некоторые полиморфизмы в генах репарации ДНК или их регуляторных последовательностях действительно вызывают фенотипические изменения и участвуют в развитии рака. Исследование случаев рака легких обнаружило умеренную связь между полиморфизмом NER-специфических SNP и риском рака легких. Результаты показывают, что некоторые унаследованные полиморфные вариации генов NER могут приводить к предрасположенности к раку легких и, возможно, к другим раковым состояниям.
Дисфункция NER результат полиморфизма ДНК
Два важных гена в пути NER, для которых полиморфизм показал функциональное и фенотипическое влияние, - это гены XPD и XPC . XPD, также известный как ERCC2, помимо других транскрипционных активностей, служит для открытия ДНК вокруг участка повреждения во время NER. Исследования показали, что полиморфизм экзона 10 (G> A) (Asp312Asn) и экзона 23 (A> T) (Lys751Gln) связан с генетической предрасположенностью к нескольким типам рака. Ген XPC отвечает за белок, который распознает ДНК на ранней стадии пути NER. Этот ген может иметь полиморфизм в интроне 9 и SNP в экзоне 15, которые также коррелируют с риском рака. Исследования показали, что полиморфизм вставки / делеции двуаллельного поли (AT) в интроне 9 XPC связан с повышенным риском рака кожи, груди и простаты, особенно в популяциях Северной Индии.
Влияние на прогноз рака
Изучение наследственного рака, xeroderma pigmentosum, помогло идентифицировать несколько генов, которые кодируют белки пути NER, два из которых - XPC и XPD. XP вызывается гомозиготной недостаточностью восстановления повреждений ДНК УФ-излучением (GG-NER), что увеличивает риск рака кожи у пациентов в 1000 раз. У гетерозиготных пациентов риск рака носит спорадический характер, но его можно предсказать на основе аналитической оценки полиморфизмов в генах репарации ДНК, связанных с XP, очищенных из лимфоцитов . В исследовании частоты рецидивов рака толстой кишки II и III стадии высокого риска полиморфизм 2251A> C XPD (ERCC2) значительно коррелировал с ранним рецидивом после химиотерапевтического лечения. Исследования показали, что эффекты полиморфных генов NER являются аддитивными, и чем выше частота вариантов, тем выше риск рака.
Старение
У людей и мышей мутации зародышевой линии в генах, задействованных в NER, вызывают признаки преждевременного старения. Эти гены и соответствующие им белки включают ERCC1 ( ERCC1 ), ERCC2 (XPD), ERCC3 ( XPB ), ERCC4 (XPF), ERCC5 (XPG), ERCC6 (CSB) и ERCC8 (CSA).
Мыши- мутанты ERCC1 с дефицитом репарации ДНК демонстрируют признаки ускоренного старения и имеют ограниченную продолжительность жизни. Ускоренное старение мутанта затрагивает множество органов.
Мутации в гене ERCC2 (XPD) могут приводить к различным синдромам: пигментной ксеродермии (XP), трихотиодистрофии (TTD) или комбинации XP и TTD (XPTTD) или комбинации XP и синдрома Кокейна (XPCS). И TTD, и CS демонстрируют признаки преждевременного старения. Эти особенности могут включать сенсоневральную глухоту , дегенерацию сетчатки, гипометилирование белого вещества, кальцификацию центральной нервной системы, снижение роста и кахексию (потерю подкожно-жировой ткани). Фибробласты XPCS и TTD от человека и мыши с мутантом ERCC2 (XPD) демонстрируют доказательства дефектного восстановления окислительных повреждений ДНК, которые могут лежать в основе сегментарных прогероидных симптомов (преждевременного старения) (см. Теорию старения повреждений ДНК ).
Мутации в гене ERCC3 (XPB) могут приводить у людей к пигментной ксеродермии (XP) или XP в сочетании с синдромом Кокейна (XPCS).
Дефицит ERCC4 (XPF) у людей приводит к множеству состояний, включая ускоренное старение.
У людей мутационные дефекты в гене ERCC5 (XPG) могут вызывать либо предрасположенное к раку состояние xeroderma pigmentosum (XP) отдельно, либо в сочетании с тяжелым расстройством нервного развития, синдромом Кокейна (CS) или младенческой летальной церебро-окулофасциальной инфекцией скелетный синдром. ERCC5 (XPG) мутантные мыши модель представляет черты преждевременного старения , включая кахексии и остеопороз с выраженными дегенеративными фенотипами в печени , так и головном мозге. У этих мутантных мышей развивается мультисистемный дегенеративный фенотип преждевременного старения, который, по-видимому, усиливает связь между повреждением ДНК и старением (см. Теорию старения повреждения ДНК ).
Синдром Кокейна (CS) возникает из-за мутаций зародышевой линии в одном из двух генов: ERCC8 (CSA) или ERCC6 (CSB). Мутации ERCC8 (CSA) обычно вызывают более умеренную форму CS, чем мутации ERCC6 (CSB). Мутации в гене CSA составляют около 20% случаев CS. Лица с CSA и CSB характеризуются тяжелым постнатальным ростом и умственной отсталостью, а также ускоренным старением, приводящим к преждевременной смерти в возрасте от 12 до 16 лет.
Снижение ЧЭИ с возрастом
В обзоре Горбунова и др., Исследования НЭР в различных клетках и тканях молодых и пожилых людей часто показывают снижение емкости НЭР с возрастом. Это снижение может быть связано со снижением конститутивных уровней белков, используемых в пути NER.
Гены, связанные с NER
| Человеческий ген (белок) | Мышь Ортолог | Дрожжевой ортолог | Метро | Функция в NER | Вход в GeneCards |
|---|---|---|---|---|---|
| CCNH ( Циклин H ) | Ccnh | CCL1 | Оба | Субъединица киназы активатора CDK (CAK) | CCNH |
| CDK7 ( циклинзависимая киназа (CDK) 7) ) | Cdk7 | KIN28 | Оба | Субъединица САК | CDK7 |
| CETN2 (Центрин-2) | Cetn2 | Неизвестный | GGR | Распознавание повреждений; образует комплекс с XPC | CETN2 |
| DDB1 ( DDB1 ) | Ddb1 | Неизвестный | GGR | Распознавание повреждений; образует комплекс с DDB2 | DDB1 |
| DDB2 ( DDB2 ) | Ddb2 / Xpe | Неизвестный | GGR | Распознавание повреждений; набирает XPC | DDB2 |
| ERCC1 ( ERCC1 ) | Ercc1 | RAD10 | Оба | Вовлечен в разрез на 3 'стороне повреждения; образует комплекс с XPF | ERCC1 |
| ERCC2 ( XPD ) | Ercc2 | RAD3 | Оба | АТФазная и геликазная активность; субъединица фактора транскрипции II H (TFIIH) | ERCC2 |
| ERCC3 ( XPB ) | Ercc3 | RAD25 | Оба | АТФазная и геликазная активность; субъединица фактора транскрипции II H (TFIIH) | ERCC3 |
| ERCC4 ( XPF ) | Ercc4 | RAD1 | Оба | Вовлечен в разрез на 3 'стороне повреждения; структурно-специфическая эндонуклеаза | ERCC4 |
| ERCC5 ( XPG ) | Ercc5 | RAD2 | Оба | Вовлечен в разрез на 5-дюймовой стороне повреждения; стабилизирует TFIIH; структурно-специфическая эндонуклеаза | ERCC5 |
| ERCC6 ( CSB ) | Ercc6 | RAD26 | TC-NER | Фактор элонгации транскрипции; участвует в сцеплении транскрипции и ремоделировании хроматина | ERCC6 |
| ERCC8 ( CSA ) | Ercc8 | RAD28 | TC-NER | Убиквитинлигазный комплекс; взаимодействует с CSB и p44 TFIIH | ERCC8 |
| LIG1 ( ДНК- лигаза I ) | Lig1 | CDC9 | Оба | Окончательная перевязка | LIG1 |
| MNAT1 ( MNAT1 ) | Mnat1 | TFB3 | Оба | Стабилизирует комплекс ЦАК | MNAT1 |
| MMS19 ( MMS19 ) | Mms19 | MET18 | Оба | Взаимодействует с субъединицами XPD и XPB геликаз TFIIH. | MMS19 |
| RAD23A ( RAD23A ) | Rad23a | RAD23 | GGR | Распознавание повреждений; образует комплекс с XPC | RAD23A |
| RAD23B ( RAD23B ) | Rad23b | RAD23 | GGR | Распознавание повреждений, образует комплекс с XPC | RAD23B |
| RPA1 ( RPA1 ) | Rpa1 | RFA1 | Оба | Подразделение комплекса РФА | RPA1 |
| RPA2 ( RPA2 ) | Rpa2 | RFA2 | Оба | Подразделение комплекса РФА | RPA2 |
| TFIIH ( фактор транскрипции II H ) | Gtf2h1 - 3 | Tfb1 Ssl1 Tfb4 | Оба | Вовлечен в разрез, образует комплекс вокруг поражения | GTF2H1 GTF2H2 GTF2H3 |
| XAB2 ( XAB2 ) | Xab2 | SYF1 | TC-NER | Распознавание повреждений; взаимодействует с XPA, CSA и CSB | XAB2 |
| XPA ( XPA ) | Xpa | RAD14 | Оба | Распознавание повреждений | XPA |
| XPC ( XPC ) | Xpc | RAD4 | GGR | Распознавание повреждений | XPC |
Смотрите также
Рекомендации
дальнейшее чтение
- Элленбергер Т., Фридберг ЕС, Уокер Г.С., Вольфрам С., Вуд Р.Дж., Шульц Р. (2006). Ремонт ДНК и мутагенез . Вашингтон, округ Колумбия: ASM Press. ISBN 978-1-55581-319-2 .
- Satoh MS, Hanawalt PC (сентябрь 1996 г.). «TFIIH-опосредованная эксцизионная репарация нуклеотидов и инициация транскрипции мРНК в оптимизированном анализе внеклеточной репарации ДНК и транскрипции РНК» . Исследования нуклеиновых кислот . 24 (18): 3576–3582. DOI : 10.1093 / NAR / 24.18.3576 . PMC 146147 . PMID 8836185 . Статья об отношениях между TFIIH и NER
- Frit P, Kwon K, Coin F, Auriol J, Dubaele S, Salles B, Egly JM (декабрь 2002 г.). «Активаторы транскрипции стимулируют репарацию ДНК» . Мол. Cell . 10 (6): 1391–1401. DOI : 10.1016 / S1097-2765 (02) 00732-3 . PMID 12504014 .
- Меллон I (сентябрь 2005 г.). «Транскрипционно-связанный ремонт: дело сложное». Мутат. Res . 577 (1-2): 155–161. DOI : 10.1016 / j.mrfmmm.2005.03.016 . PMID 15913669 .
Внешние ссылки
-
 СМИ, связанные с эксцизионной репарацией нуклеотидов на Викискладе?
СМИ, связанные с эксцизионной репарацией нуклеотидов на Викискладе?