Нитрил-анион - Nitrile anion
Нитрильные анионы - это нитрилы, в которых отсутствует протон в положении α к нитрильной группе. Они претерпевают реакции нуклеофильного присоединения и замещения с различными электрофилами .
Несмотря на то, нитриловые анионы функционально аналогичны еноляты , дополнительная кратная связь в нитрильных анионах обеспечивает их уникальной кетена геометрией -подобной. Кроме того, депротонированные циангидрины могут действовать как замаскированные ацильные анионы, давая продукты, недоступные для одних енолятов. Механизмы присоединения и замещения нитрила хорошо изучены; однако обычно требуются строго основные условия, ограничивающие синтетическую применимость реакции.
Механизм и стереохимия
Генерация нитрильных анионов
Нитрил-анионы чаще всего образуются под действием соответствующего основания. Однако p K a s нитрилов охватывает широкий диапазон - не менее 20 p K a единиц. Таким образом, правильный выбор основы обычно зависит от основания. Ацетонитрилы, содержащие дополнительную стабилизирующую электроноакцепторную группу (такую как ароматическое кольцо), обычно можно депротонировать с использованием гидроксидных или алкоксидных оснований. С другой стороны, нестабилизированные нитрилы обычно требуют либо оснований амидов щелочных металлов (таких как NaNH 2 ), либо алкилов металлов (таких как бутиллитий ) для эффективного депротонирования. В последнем случае происходит конкурентное присоединение алкильной группы к нитрилу.

Исследования ИК-спектроскопии продемонстрировали существование по крайней мере двух таутомерных форм нитрил-аниона (см. Выше).
Полианионы нитрилов также могут быть образованы путем многократного депротонирования, и эти частицы производят полиалкилированные продукты в присутствии алкилэлектрофилов.
Альтернативные методы получения нитрильных анионов включают сопряженное добавление к α, β-ненасыщенным нитрилам, восстановление и трансметаллирование.
Реакции нитриланионов
Механизмы реакций с участием анионов нитрила зависят в первую очередь от природы задействованного электрофила . Простое алкилирование происходит за счет замещения S N 2 и подчиняется обычным стереоэлектронным требованиям процесса. Катализ с переносом фазы использовался при алкилировании арилацетонитрилов. Анионы нитрила также могут участвовать в присоединениях типа Михаэля к активированным двойным связям и реакциям винилирования с ограниченным числом поляризованных, беспрепятственных производных ацетилена.

Арилирование нитрильных анионов также возможно и может происходить по разным механизмам в зависимости от субстратов и условий реакции. Арилгалогениды, в которых отсутствуют электроноакцепторные группы, реагируют по механизму присоединения-отщепления с участием бензиновых промежуточных соединений. Арилфосфаты и аммоний реагируют по пути S RN 1 , который включает образование анион-радикала арила, фрагментацию и образование связи с нуклеофилом. Перенос электрона на вторую молекулу арена осуществляется по радикальной цепи.
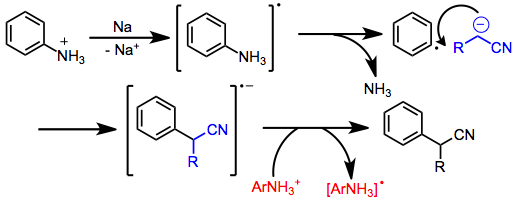
Бедные электронами ароматические соединения подвергаются нуклеофильному ароматическому замещению в присутствии нитрильных анионов.
Объем и ограничения
Основная трудность реакций алкилирования с использованием нитрильных анионов - это чрезмерное алкилирование. Например, при алкилировании ацетонитрила выход моноалкилированного продукта в большинстве случаев низок. Двумя исключениями являются алкилирование эпоксидами (близлежащий отрицательный заряд открытого эпоксида препятствует дальнейшему алкилированию) и алкилирование частицами цианометилмеди (I). Побочные реакции также могут представлять проблему; концентрации аниона нитрила должны быть высокими, чтобы смягчить процессы, включающие самоконденсацию, такие как реакция Торпа-Циглера . Другие важные побочные реакции включают отщепление продукта алкилцианида или исходного материала алкилгалогенида и образование амидина .
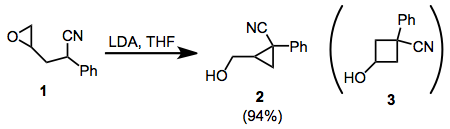
Циклизация ω-эпокси-1-нитрилов представляет собой интересный пример того, как стереоэлектронные факторы могут преобладать над стерическими факторами в реакциях внутримолекулярного замещения. При циклизации 1 , например, наблюдается только изомер циклопропана 2 . Это объясняется лучшим перекрытием орбиталей в переходном состоянии S N 2 для циклизации. 1,1-дизамещенные и тетразамещенные эпоксиды также следуют этому принципу.
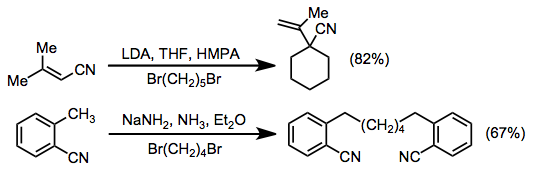
Конъюгированные нитрилы, содержащие γ-атомы водорода, могут быть депротонированы в γ-положении с образованием резонансно-стабилизированных анионов. Эти промежуточные продукты почти всегда реагируют с α-селективностью в реакциях алкилирования, за исключением анионов орто- толилнитрилов.
Образование циангидринов из карбонильных соединений делает первый карбонильный углерод кислым. После защиты гидроксильной группы ацильной или силильной группой циангидрины могут действовать по существу как замаскированные ацильные анионы. Поскольку сложноэфирные защитные группы неустойчивы к основаниям, с циангидринами, защищенными сложным эфиром, должны использоваться мягкие основания. В этом контексте также можно использовать α- (диалкиламино) нитрилы.
Примеры реакций арилирования и ацилирования показаны ниже. Хотя межмолекулярное арилирование с использованием нитрильных анионов приводит к умеренным выходам, внутримолекулярная процедура эффективно дает четырех-, пяти- и шестичленные бензоконденсированные кольца. Ацилирование может быть выполнено с использованием широкого ряда ацил-электрофилов, включая карбонаты, хлорформиаты, сложные эфиры , любые гидриды и хлорангидриды . В этих реакциях используются два эквивалента основания, чтобы привести реакцию к ацилированному продукту - ацилированный продукт более кислый, чем исходный материал.

Синтетические приложения
Алкилирование нитрильного аниона с последующим восстановительным децианированием было использовано в новом синтезе ( Z ) -9-додецен-1-илацетата, полового феромона Paralobesia viteana .
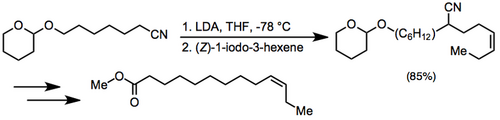
Условия и порядок экспериментов.
Типичные условия
Наиболее распространенными основаниями, используемыми для депротонирования нитрилов, являются амиды щелочных металлов, замещенные амиды и гидриды. Эти реагенты требуют инертных безводных условий и осторожного обращения. Полиалкилирование является серьезной проблемой для первичных или вторичных нитрилов; Однако существует ряд решений этой проблемы. Алкилирование цианоацетатов с последующим декарбоксилированием дает одно решение. Ацилирование первичных или вторичных нитрилов обеспечивает удобный ввод исходных материалов для этой последовательности. Дистилляция и хроматография применимы только для разделения моно- и диалкилированного материала, когда разница в молекулярной массе между ними велика.
Ацилирование намного проще, так как полученные α-цианокарбонильные соединения намного более кислые (и менее нуклеофильные), чем соответствующие исходные материалы. Моноацилированные продукты можно легко получить.
Пример процедуры
К суспензии 24,4 г (1,017 моль) гидрида натрия в 200 мл безводного толуола добавляли смесь 122 г (1,043 моль) фенилацетонитрила и 150 г (1,095 моль) изобутилбромида. Смесь нагревали до 65 ° C, при этой температуре начиналась реакция. Нагревательный кожух удаляли, и колбу охлаждали, чтобы не допустить слишком интенсивной реакции в течение начального получасового периода реакции. Реакционную смесь кипятили с обратным холодильником еще 5 часов и оставляли на ночь. По каплям осторожно добавляли этанол (40 мл) с последующим добавлением по каплям 200 мл воды. Органический слой отделяли, а водный слой экстрагировали бензолом . Объединенные органические слои последовательно промывали разбавленной кислотой, водой, раствором карбоната натрия и водой. После фильтрации через слой сульфата натрия , бензол выпаривали и продукт фракционной перегонке с получением 115 г (66%) 2-фенил-4-methylvaleronitrile, кип 130-134 ° C (10 мм) [лит (540) кип 136-138 ° C (15 мм)].

