Оксид йода - Iodine oxide

Йод оксиды являются химическими соединениями из кислорода и йода . У йода есть только два стабильных оксида, которые можно выделить в массе, тетроксид йода и пятиокись йода , но ряд других оксидов образуется в следовых количествах или предположительно существует. Химия этих соединений сложна, лишь некоторые из них хорошо охарактеризованы. Многие из них были обнаружены в атмосфере и считаются особенно важными в морском пограничном слое.
| Молекулярная формула | I 2 O | IO | IO 2 | И 2 О 4 | И 2 О 5 | I 4 O 9 |
|---|---|---|---|---|---|---|
| Имя | оксид дииода | оксид йода | диоксид йода | четырехокись йода
(тетроксид дийода) |
Пятиокись йода
(пятиокись дийода) |
неоксид тетрайода |
| Состав | I 2 O | IO | IO 2 | (IO 2 ) 2 | O (IO 2 ) 2 | I (OIO 2 ) 3 |
| Молекулярная модель |
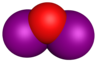
|

|

|
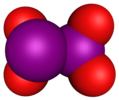
|

|
|
| Реестр CAS | 39319-71-6 | 14696-98-1 | 13494-92-3 | 1024652-24-1 | 12029-98-0 | 66523-94-2 |
| Появление | Неизвестный | пурпурный газ | желтое твердое вещество | желтое твердое вещество | белое кристаллическое твердое вещество | темно-желтое твердое вещество |
| Состояние окисления | +1 | +2 | +4 | +3 и +5 | +5 | +3 и +5 |
| Температура плавления | не изолируемый | не изолируемый | не изолируемый | разложить 100 ° С | разложить 300–350 ° С | разложить 75 ° С |
| Удельный вес | 4.2 | 4.8 | ||||
| Растворимость в воде | разложить в HIO 3 + I 2 | 187 г / 100 мл | разложить в HIO 3 + I 2 |
Моноксид дийода в значительной степени был предметом теоретических исследований, но есть некоторые свидетельства того, что его можно получить аналогично монооксиду дихлора посредством реакции между HgO и I 2 . Соединение кажется очень нестабильным, но может реагировать с алкенами с образованием галогенированных продуктов.
Радикальный оксид йода (IO), диоксид йода (IO 2 ) и тетроксид йода ((IO 2 ) 2 ) - все они обладают значительным и взаимосвязанным химическим составом атмосферы. Они образуются, в очень небольших количествах, на морском пограничном слое по фотоокислении из дийодметан , который получают путем макроводорослью , таких как водоросли , или за счет окисления молекулярного йода, полученной за счет реакции газообразного озона и йодида присутствующих на seasurface. Несмотря на то, что их производят в небольших количествах (обычно ниже ppt ), они считаются мощными озоноразрушающими веществами.
Diiodine пентоксид (I 2 O 5 ) представляет собой ангидрид из йодной кислоты и только стабильного ангидрида йода оксокислоты .
Ноноксид тетраиода (I 4 O 9 ) был получен путем газофазной реакции I 2 с O 3, но не был широко изучен.
Йодат-анионы
Оксиды йода также образуют отрицательно заряженные анионы , которые (связанные с дополнительными катионами) являются компонентами кислот или солей. К ним относятся йодаты и периодаты .
Их сопряженные кислоты :
| Степень окисления йода | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Имя | Йодоводород * | Гипойодистая кислота | Йодистая кислота | Йодная кислота | Периодическая кислота |
| Формула | ПРИВЕТ | HIO | HIO 2 | HIO 3 | HIO 4 или H 5 IO 6 |
• Степень окисления -1, йодистый водород, не является оксидом, но он включен в эту таблицу для полноты картины.
Периодаты включают два варианта: метапериодат IO. -
4 и ортопериодат IO 5-
6 .
Смотрите также
Рекомендации
