Иммуноцитохимия - Immunocytochemistry
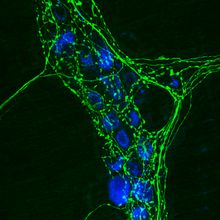
Иммуноцитохимия ( ICC ) - это распространенный лабораторный метод, который используется для анатомической визуализации локализации определенного белка или антигена в клетках с помощью специфического первичного антитела, которое с ним связывается. Первичное антитело позволяет визуализировать белок под флуоресцентным микроскопом, когда он связывается вторичным антителом , имеющим конъюгированный флуорофор . ICC позволяет исследователям оценить, экспрессируют ли клетки в конкретном образце рассматриваемый антиген. В случаях, когда обнаруживается иммуноположительный сигнал, ICC также позволяет исследователям определить, какие субклеточные компартменты экспрессируют антиген.
Иммуно цито химия против иммуно гисто химия
Иммуноцитохимия отличается от иммуногистохимии тем, что первая проводится на образцах интактных клеток, у которых была удалена большая часть, если не все, окружающий внеклеточный матрикс . Сюда входят отдельные клетки, которые были выделены из блока твердой ткани, клетки, выращенные в культуре , клетки, депонированные из суспензии , или клетки, взятые из мазка . Напротив, иммуногистохимические образцы представляют собой срезы биологической ткани , где каждая клетка окружена тканевой архитектурой, а другие клетки обычно находятся в неповрежденной ткани. Иммуноцитохимия - это метод, используемый для оценки присутствия определенного белка или антигена в клетках (культивируемых клетках, клеточных суспензиях) с помощью специфического антитела, которое связывается с ним, что позволяет визуализировать и исследовать под микроскопом. Это ценный инструмент для определения клеточного содержимого отдельных клеток. Образцы, которые можно проанализировать, включают мазки крови, аспираты, мазки, культивированные клетки и клеточные суспензии.
Есть много способов подготовить образцы клеток для иммуноцитохимического анализа. Каждый метод имеет свои сильные стороны и уникальные характеристики, поэтому можно выбрать правильный метод для желаемой выборки и результата.
Клетки, подлежащие окрашиванию, можно прикрепить к твердой подложке, чтобы облегчить использование в последующих процедурах. Этого можно добиться несколькими способами: прилипшие клетки можно выращивать на предметных стеклах микроскопа, покровных стеклах или на оптически подходящей пластиковой подложке. Суспензионные клетки можно центрифугировать на предметных стеклах ( цитоспин ), связать с твердой подложкой с помощью химических линкеров или, в некоторых случаях, обращаться с суспензией.
Концентрированные клеточные суспензии, существующие в среде с низкой вязкостью, являются хорошими кандидатами для приготовления мазков. Разбавленные суспензии клеток, существующие в разбавленной среде, лучше всего подходят для получения цитоспинов путем цитоцентрифугирования. Суспензии клеток, существующие в среде с высокой вязкостью, лучше всего подходят для тестирования в качестве препаратов мазков. Постоянным среди этих препаратов является то, что вся клетка присутствует на поверхности предметного стекла. Для того, чтобы произошла какая-либо межклеточная реакция, иммуноглобулин должен сначала пройти через клеточную мембрану, которая не повреждена в этих препаратах. Реакции, происходящие в ядре, могут быть более сложными, а внеклеточные жидкости могут создавать уникальные препятствия для выполнения иммуноцитохимии. В этой ситуации становится необходимым повышение проницаемости клеток с помощью детергента (Triton X-100 или Tween-20) или выбора органических фиксаторов (ацетон, метанол или этанол).
Антитела - важный инструмент для демонстрации как наличия, так и субклеточной локализации антигена. Окрашивание клеток - это очень универсальный метод, и, если антиген сильно локализован, он может обнаружить всего лишь тысячу молекул антигена в клетке. В некоторых случаях окрашивание клеток также может использоваться для определения приблизительной концентрации антигена, особенно с помощью анализатора изображений.
Методы
Существует множество методов иммунологического обнаружения тканей, включая методы, непосредственно связанные с первичными антителами или антисыворотками. Прямой метод включает использование детектируемой метки (например, флуоресцентной молекулы, частиц золота и т. Д.) Непосредственно к антителу, которому затем позволяют связываться с антигеном (например, белком) в клетке.
Как вариант, существует множество косвенных методов . В одном из таких методов антиген связывается с первичным антителом, которое затем амплифицируется с использованием вторичного антитела, которое связывается с первичным антителом. Затем наносится третичный реагент, содержащий ферментный фрагмент, который связывается со вторичным антителом. Когда применяется четвертичный реагент или субстрат, ферментативный конец третичного реагента превращает субстрат в продукт реакции пигмента, который дает цвет (возможны многие цвета; коричневый, черный, красный и т. Д.) В том же самом место, где исходное первичное антитело распознало интересующий антиген.
Некоторыми примерами используемых субстратов (также известных как хромогены) являются AEC (3-амино-9-этилкарбазол) или DAB ( 3,3'-диаминобензидин ). Использование одного из этих реагентов после воздействия необходимого фермента (например, пероксидазы хрена, конъюгированной с реагентом антител) дает положительный продукт иммунореакции. Иммуноцитохимическая визуализация конкретных представляющих интерес антигенов может использоваться, когда менее специфическое окрашивание, такое как H&E (гематоксилин и эозин), не может использоваться для постановки диагноза или для предоставления дополнительной прогностической информации относительно лечения (например, при некоторых формах рака).
В качестве альтернативы вторичное антитело может быть ковалентно связано с флуорофором ( наиболее распространены FITC и родамин ), который обнаруживается с помощью флуоресцентного или конфокального микроскопа. Местоположение флуоресценции будет варьироваться в зависимости от молекулы-мишени, внешнее для мембранных белков и внутреннее для цитоплазматических белков. Таким образом, иммунофлуоресценция является мощным методом в сочетании с конфокальной микроскопией для изучения локализации белков и динамических процессов ( экзоцитоз , эндоцитоз и т. Д.).
