Аллотропы мышьяка - Allotropes of arsenic
Мышьяк в твердом состоянии можно найти в виде аллотропов серого, черного или желтого цвета . Эти различные формы имеют различные структурные мотивы, включая желтый мышьяк, обеспечивающий самый широкий диапазон реакционной способности. В частности, реакция желтого мышьяка с элементами основной группы и переходными металлами приводит к соединениям с широким диапазоном структурных мотивов, с наиболее заметными фрагментами типа бабочки , сэндвича и реальгара .
Серый мышьяк
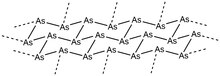
Серый мышьяк или металлический мышьяк является наиболее стабильным аллотропом элемента при комнатной температуре и, как таковой, является его наиболее распространенной формой. Этот мягкий, хрупкий аллотроп мышьяка имеет стальной серый металлический цвет и является хорошим проводником. Ромбоэдрическая форма этого аллотропа аналогична фосфорному аллотропу черному фосфору. В своей α-форме кольца As 6 в подтверждениях кресла конденсируются в упакованные слои, расположенные перпендикулярно кристаллографической оси c . Внутри каждого слоя расстояния вицинальных связей As-As составляют 2,517 Å, а расстояния между слоями As-As составляют 3,120 Å. Общая структура демонстрирует искаженную октаэдрическую геометрию, что в значительной степени приводит к металлическим свойствам этого аллотропа. После сублимации при 616 ° C молекулы мышьяка в газовой фазе теряют эту упаковку и образуют небольшие кластеры As 4 , As 2 и As, хотя As 4 является наиболее распространенным в этой фазе. Если эти пары быстро конденсируются на холодной поверхности (<200 K), образуется твердый желтый мышьяк (As 4 ) из-за недостатка энергии, необходимой для образования ромбоэдрической серой решетки мышьяка. И наоборот, при конденсации паров мышьяка на нагретой поверхности образуется аморфный черный мышьяк. Кристаллическая форма черного мышьяка также может быть выделена, а аморфная форма может быть отожжена для возврата к металлической серой форме мышьяка. Желтый мышьяк также может быть легко возвращен серому аллотропу путем воздействия света или путем возврата молекулы к комнатной температуре.
Реактивность
Сообщалось об относительно небольшом количестве реакций на месте с участием серого мышьяка из-за его низкой растворимости, хотя он реагирует на воздухе с образованием газообразного As 2 O 3 . Известны два примера реакционной способности серого мышьяка по отношению к переходным металлам. В этих реакциях циклопентадиенильные комплексы молибдена, вольфрама и хрома протекают через потерю монооксида углерода, вступая в реакцию с серым мышьяком и образуя соединения моно-, ди- и триышьяка.
Черный мышьяк
Черный или аморфный мышьяк (химическая формула As n ) синтезируется сначала путем сублимации серого мышьяка с последующей конденсацией на нагретой поверхности. Эта структура считается аналогом красного фосфора мышьяка . Структура черного мышьяка в его кристаллической фазе, хотя и не синтезируется в чистом виде, по расширению аналогична черному фосфору и принимает орторомбическую структуру, построенную из колец As 6 . Черный мышьяк до сих пор был синтезирован только в присутствии атомарных примесей, включая ртуть, фосфор и кислород, хотя чистая форма черного мышьяка была обнаружена в районе Копьяпо в Чили . Механическое расслоение минерала арсеноламприта, обнаруженного в чилийских пещерах, выявило молекулярную структуру с высокой синфазной анизотропией и потенциалом полупроводникового материала.
Желтый мышьяк
Быстрая конденсация паров мышьяка на холодной поверхности приводит к образованию желтого мышьяка (As 4 ), состоящего из четырех атомов мышьяка, расположенных в тетраэдрической геометрии, аналогичной белому фосфору . Хотя это единственная известная растворимая форма мышьяка, желтый мышьяк является метастабильным : при комнатной температуре или в присутствии света структура быстро разлагается, принимая конфигурацию серого мышьяка с более низкой энергией. По этой причине требуется тщательная осторожность для поддержания желтого мышьяка в состоянии, подходящем для реакции, включая строгое исключение света и поддержание температуры ниже -80 ° C. Желтый мышьяк является аллотропом, наиболее подходящим для изучения реакционной способности, из-за его растворимости (низкой, но сравнительно большой по сравнению с металлическим аллотропом) и молекулярной природы. По сравнению с его более легким аналогом, фосфором , реакционная способность мышьяка сравнительно мало изучена. Исследования по изучению реакций с мышьяком в первую очередь связаны с активацией соединений основных групп и переходных металлов; в случае комплексов переходных металлов As 4 продемонстрировал компетентную реакционную способность через d-блок периодической таблицы.
Реакционная способность по отношению к соединениям основной группы
О первой активации соединения основной группы желтым мышьяком сообщили в 1992 году Уэст и его коллеги, включая реакцию As 4 с дисиленовым соединением, тетрамезитилдисиленом, с образованием смеси соединений, включающей структурный мотив «бабочка» из мостиковых атомов мышьяка. Примечательно, что смесь продуктов, полученная в этой реакции, отличается от аналогичной реакции с P 4, которая дает только соединение бабочки, подчеркивая, что реакционная способность желтого мышьяка и белого фосфора не может считаться идентичной. Первое органическое замещенное соединение As 4 было получено Шеером и его сотрудниками в 2016 году в результате реакции с радикалом Cp PEt . Аналогично соединению бабочки, полученному группой West, продукт, полученный в этой реакции, содержал мостиковый мотив As 4, который обратимо возвращал As 4 и исходный радикал в присутствии света или тепла. Эта характеристика делает комплекс Cp PEt 2 As 4 уникально подходящей «запасающей» молекулой для желтого мышьяка, поскольку он стабилен при хранении при комнатной температуре в темноте, но может выделять As 4 в термических или фотохимических растворах.
Было показано, что в других реакциях соединений основной группы с желтым мышьяком участвуют единицы мышьяка с более чем четырьмя атомами. В реакции с силиленовым соединением [PhC (N т Bu) 2 SiN (SiMe 3 ) 2 ], агрегация As 4 наблюдали с образованием клетки соединения десяти атомов мышьяка, в том числе семь - членный мышьяк кольца в его центре.
Реакционная способность по отношению к соединениям переходных металлов
Металлы 4 и 5 групп
Среди ранних элементов переходных металлов (группы 4 и 5) до настоящего времени сообщалось о нескольких примерах активации мышьяком. Было показано, что комплексы оксида углерода циркония с дериватизированными циклопентадиенильными лигандами реагируют с желтым мышьяком в кипящем ксилоле с высвобождением CO и связыванием фрагмента As 4 в режиме η 1: 1 . Следовые количества димер циркония мостиком с помощью (M, η 2: 2: 1 -В 5 ) -moiety также сообщалось в данном исследовании, в котором описывается комплексы в качестве возможных реагентов для В 4 передачи. В группе 5 активация мышьяка была изучена более широко, известны комплексы как ниобия, так и тантала. Исследование топологии электронной плотности в системе, содержащей фосфор / мышьяк / ниобий, продемонстрировало уникальную η 2 -связывающую конфигурацию в этих комплексах, в которой двойная связь мышьяк-фосфор соединяется сбоку с центром ниобия.
Металлы 6 группы
Реакции желтого мышьяка с переходными металлами 6-й группы в основном протекают через термолитическое отщепление монооксида углерода в карбонильных комплексах хрома и молибдена. Известные примеры включают образование трехуровневых комплексов [(Cp R Mo) 2 (μ, η 6 -As 6 )] и [{Cp R Cr} 2 (μ, η 5 -As 5 )] посредством реакции соответствующих димеры молибдена и хрома с желтым мышьяком. Эти замечательные структуры имеют три плоских кольца, расположенных параллельно, что дает идеализированную точечную группу D 5h для комплекса хрома. Обе эти реакции требуют жестких условий реакции, таких как кипение ксилола, чтобы преодолеть высокие барьеры для активации As 4 . И наоборот, использование лигандов с более высокими стерическими требованиями к металлическому центру позволило проводить реакции в более мягких условиях с молибденом и хромом. Катализатор Cummins Mo (N ( t Bu) Ar) 3 , также известный как расщепляющий тройную связь NN в диазоте, реагирует с желтым мышьяком с образованием концевого фрагмента мышьяка, тройного связанного с металлическим центром - одного из нескольких соединений, известных как содержат концевой атом мышьяка. Комплексы с кратными связями металл-металл также обеспечивают мягкий параметр активации As 4 . Хром-хром пятисвязный вид, о котором сообщил Кемпе, реагирует с желтым мышьяком с образованием краун-комплекса, в котором четыре атома мышьяка образуют приблизительно тетраэдрическую структуру, где каждый атом хрома связан с тремя атомами мышьяка.
Металлы 8 и 9 групп
Металлы групп 8 и 9 имеют самую обширную библиотеку реакционной способности с желтым мышьяком, задокументированную в научной литературе, с особым вниманием к реакциям комплексов железа и кобальта с As 4 . Подобно сэндвич-комплексам хрома и молибдена, комплексы (Cp R Fe (CO) 2 ] 2 железа реагируют с желтым мышьяком с образованием аналогичных биметаллических продуктов с геометрией «трехуровневой». В этих отчетах также подробно описывается выделение ключевого промежуточного соединения, пентаарсаферроцен ([Cp R Fe (μ 5 -As 5 )]). Этот промежуточный продукт, изолобальный ферроцену, заменяет один из циклопентадиенильных лигандов циклическим лигандом As 5, который имеет длину связи As-As 2,312 Å (в соответствии с делокализованными As-As двойные связи). Эту «сэндвич-образующую» реакционную способность можно значительно регулировать путем введения более объемных лигандов. Модификация циклопентадиенильных групп гораздо более объемными производными дает совершенно другой набор продуктов. Во-первых, комплекс «бабочка» с центральным звеном As 4 Облучение светом приводит к дальнейшему удалению CO и образованию мостикового комплекса бабочки, который затем перестраивается в уникальный комплекс с центральным фрагментом As 8. Этот лиганд, формально тетраанионный, образует s восьмичленное кольцо, соединяющее в общей сложности четыре атома железа.
Большая часть такой же реакционной способности, включая образование соединений типа бабочка и сэндвич, была описана для комплексов кобальта в присутствии желтого мышьяка. Помимо этих соединений, история реакционной способности кобальта и желтого мышьяка восходит к 1978 году, когда Саккони и его коллеги сообщили о реакции тетрафторбората кобальта и желтого мышьяка в присутствии трифоса . Полученный комплекс имеет циклический фрагмент As 3, соединяющий два центра кобальта, из которых первый формально обозначен как 3π-электронная система. Реакция димера [Cp * Co (CO)] 2 с желтым мышьяком была показана Scherer et al. для производства широкого разнообразия выделяемых продуктов, включающих смесь связывающих фрагментов мышьяка, включая циклобутаноподобные комплексы и комплексы типа бабочки. Известны также аналогичные реакции с комплексами родия.
Металлы 10 и 11 групп
Среди элементов групп 10 и 11 никель и медь наиболее заметно фигурируют в литературных реакциях с желтым мышьяком. Соли тетрафторбората никеля реагируют аналогично комплексам кобальта в присутствии трифоса с образованием сэндвич-структуры с центральным циклическим фрагментом As 3 . Подобно железу, реакция циклопентадиенилкарбонильных комплексов никеля с As 4 дает множество биметаллических и мультиметаллических продуктов в зависимости от размера сопутствующих лигандов, хотя природа и геометрическая структура этих соединений отличаются от тех, которые наблюдаются с железом. К ним относятся тримеры с мостиковыми остатками As 4 и As 5 в кубановых структурных структурах, когда используются меньшие лиганды Cp, и комплексы искаженной гексагональной призмы с двумя фрагментами никеля и четырьмя атомами мышьяка, когда вводятся более объемные группы Cp.
Реакция комплекса меди [L 2 Cu (NCMe)] (L 2 = [{N (C 6 H 3 i Pr 2 -2,6) C (Me)} 2 CH]) с желтым мышьяком дает As 4 -мостиковый димер [{L 2 Cu} 2 - (μ, η 2: 2 -As 4 )]. Фрагмент четырехатомного мышьяка в этом комплексе был признан «неповрежденным» желтым мышьяком с помощью расчетов по теории функционала плотности, определяющих изменение критических точек связи между свободными и связанными молекулами мышьяка. В частности, наблюдался лишь небольшой сдвиг в критических точках связи между атомами мышьяка, участвующими в связывании с медью; остальные критические точки связи были очень похожи на свободный желтый мышьяк.
Смотрите также
Рекомендации
- ^ a b c d e f g Зейдл, Майкл; Балаж, Габор; Шеер, Манфред (22 марта 2019 г.). «Химия желтого мышьяка» . Химические обзоры . 119 (14): 8406–8434. DOI : 10.1021 / acs.chemrev.8b00713 . ISSN 0009-2665 .
- ^ «Аллотроп: Мышьяк» . dirkncl.github.io . Проверено 1 ноября 2020 .
- ^ а б Циглер, ML (1988). "Darstellung und Charakterisierung von Tetrahedranen des Typs Cp3M3As (CO) 6 und Cp2M2As2 (CO) 4 (Cp = C5H5, M = Mo, W) sowie von Derivaten dieser Tetrahedrane" . Chemische Berichte . 121 (1). DOI : 10.1002 / cber.v121: 1 . ISSN 0009-2940 .
- ^ a b Го, Лай Юн .; Вонг, Ричард К.С.; Ип, Вай Хинг .; Мак, Томас CW (1991). «Синтез и термолиз ди- и триышьяковых комплексов хрома. Кристаллическая структура [CpCr (CO) 2] 2As2» . Металлоорганические соединения . 10 (4): 875–879. DOI : 10.1021 / om00050a015 . ISSN 0276-7333 .
- ^ Чен, Ябинь; Чен, Чаоюй; Кеалхофер, Роберт; Лю, Хуэйли; Юань, Чжицюань; Цзян, Лили; Су, Джунки; Пак, Джонсук; Ко, Чанхён; Чхве, Хван Сон; Авила, Хосе (2018). «Черный мышьяк: слоистый полупроводник с экстремальной плоской анизотропией» . Современные материалы . 30 (30): 1800754. DOI : 10.1002 / adma.201800754 . ISSN 1521-4095 .
- ^ Тан, Робин П .; Комерлато, Надя М .; Пауэлл, Дуглас Р.; Запад, Роберт (1992). «Реакция тетрамезитилдисилена с As4: синтез и структура новой трициклической кольцевой системы мышьяк – кремний» . Angewandte Chemie International Edition на английском языке . 31 (9): 1217–1218. DOI : 10.1002 / anie.199212171 . ISSN 1521-3773 .
- ^ а б Хайнл, Себастьян; Балаж, Габор; Стаубер, Андреас; Шеер, Манфред (15.11.2016). «CpPEt2As4-Органическое замещенное соединение As4Butterfly» . Angewandte Chemie International Edition . 55 (50): 15524–15527. DOI : 10.1002 / anie.201608478 . ISSN 1433-7851 .
- ^ a b Зейтц, Андреас Э .; Экхардт, Мария; Sen, Sakya S .; Эрлебах, Андреас; Пересыпкина, Евгения В .; Роески, Герберт В .; Сиерка, Марек; Шеер, Манфред (2017). «Различная реакционная способность As4 по отношению к дисиленам и силиленам» . Angewandte Chemie International Edition . 56 (23): 6655–6659. DOI : 10.1002 / anie.201701740 . ISSN 1521-3773 .
- ^ a b Спинни, Хизер А .; Пиро, Николас А .; Камминс, Кристофер К. (11 ноября 2009 г.). «Реакционная способность тройной связи комплексного промежуточного соединения AsP: синтез, исходящий из молекулярного мышьяка, As4» . Журнал Американского химического общества . 131 (44): 16233–16243. DOI : 10.1021 / ja906550h . ЛВП : 1721,1 / 65118 . ISSN 0002-7863 .
- ^ Шмидт, Моника; Зейтц, Андреас Э .; Экхардт, Мария; Балаж, Габор; Пересыпкина, Евгения В .; Вировец, Александр В .; Ридлбергер, Феликс; Боденштайнер, Майкл; Zolnhofer, Eva M .; Мейер, Карстен; Шеер, Манфред (27.09.2017). «Реагент переноса для связывания изомеров комплексов железа» . Журнал Американского химического общества . 139 (40): 13981–13984. DOI : 10.1021 / jacs.7b07354 . ISSN 0002-7863 .
- ^ Шерер, Отто Дж .; Вондунг, Юрген; Wolmershäuser, Gotthelf (1989). «Тетрафосфациклобутадиен как комплексный лиганд» . Angewandte Chemie International Edition на английском языке . 28 (10): 1355–1357. DOI : 10.1002 / anie.198913551 . ISSN 1521-3773 .
- ^ Шерер, Отто Дж .; Видеманн, Вольфганг; Wolmershäuser, Gotthelf (1990). «Хром-комплекс митцикло-Asx-Liganden» . Chemische Berichte (на немецком языке). 123 (1): 3–6. DOI : 10.1002 / cber.19901230102 .
- Перейти ↑ Scherer, OJ (1989). «Трехэтажный сэндвич-комплекс с недеформированным циклическим пентаарсановым средним слоем». J. Organomet. Chem . 361 : С11-С14.
- Перейти ↑ Scherer, OJ (1989). «Трехэтажный сэндвич-комплекс с недеформированным циклическим пентаарсановым средним слоем». J. Organomet. Chem . 361 : С11-С14.
- ^ Шерер, Отто Дж .; Видеманн, Вольфганг; Wolmershäuser, Gotthelf (1990). «Хром-комплекс митцикло-Asx-Liganden» . Chemische Berichte (на немецком языке). 123 (1): 3–6. DOI : 10.1002 / cber.19901230102 .
- ^ Керли, Джон Дж .; Пиро, Николас А .; Камминс, Кристофер К. (19 октября 2009 г.). «Конечный комплекс арсенида молибдена, синтезированный из желтого мышьяка» . Неорганическая химия . 48 (20): 9599–9601. DOI : 10.1021 / ic9016068 . ЛВП : 1721,1 / 64721 . ISSN 0020-1669 .
- ^ Шварцмайер, Кристоф; Нур, Аваль; Глатц, Гермунд; Забель, Манфред; Тимошкин Алексей Юрьевич; Cossairt, Brandi M .; Камминс, Кристофер С .; Кемпе, Ретт; Шеер, Манфред (2011). «Образование цикло-E42− единиц (E4 = P4, As4, AsP3) комплексом с пятикратной связью CrCr» . Angewandte Chemie International Edition . 50 (32): 7283–7286. DOI : 10.1002 / anie.201102361 . ISSN 1521-3773 .
- ^ а б Шварцмайер, Кристоф; Тимошкин Алексей Юрьевич; Балаж, Габор; Шеер, Манфред (2014). «Избирательное образование и необычная реакционная способность комплексов тетраарсабицикло [1.1.0] бутана» . Angewandte Chemie International Edition . 53 (34): 9077–9081. DOI : 10.1002 / anie.201404653 . ISSN 1521-3773 .
- ^ Scherer, OJ; Блат, Кристоф; Вольмершойзер, Готтхельф (01.05.1990). «Ферроцен мит эйнем пентаарсациклопентадиенил-лиганден» . Журнал металлоорганической химии (на немецком языке). 387 (2): C21 – C24. DOI : 10.1016 / 0022-328X (90) 80029-Y . ISSN 0022-328X .
- ^ а б Ди Вайра, Массимо; Мидоллини, Стефано; Саккони, Луиджи (1979). «Цикло-трифосфор и циклотриышьяк как лиганды в« двойных сэндвич-комплексах »кобальта и никеля» . Журнал Американского химического общества . 101 (7): 1757–1763. DOI : 10.1021 / ja00501a019 . ISSN 0002-7863 .
- ^ Шерер, Отто Дж .; Пфайффер, Карл; Wolmershäuser, Gotthelf (1992-11-01). «Кобальткомплекс с Ас4-Лиганден» . Chemische Berichte . 125 (11): 2367–2372. DOI : 10.1002 / cber.19921251107 . ISSN 0009-2940 .
- ^ Шерер, Отто Дж .; Höbel, Bernd; Wolmershäuser, Gotthelf (1992). "Zweifach kantengeöffnetes P10-Dihydrofulvalen als 16-Elektronendonorligand" . Angewandte Chemie . 104 (8): 1042–1043. DOI : 10.1002 / ange.19921040811 . ISSN 0044-8249 .
- ^ Спитцер, Фабиан; Сиерка, Марек; Латронико, Марио; Мастрорилли, Пьеро; Вировец, Александр В .; Шеер, Манфред (2015). «Фиксация и высвобождение интактных тетраэдров E4 (E = P, As)» . Angewandte Chemie International Edition . 54 (14): 4392–4396. DOI : 10.1002 / anie.201411451 . ISSN 1521-3773 .