ANGPTL4 - ANGPTL4
Ангиопоэтинподобный 4 представляет собой белок , который у человека кодируется ANGPTL4 гена . Описаны альтернативно сплайсированные варианты транскриптов, кодирующие разные изоформы. Этот ген ранее назывался ANGPTL2, HFARP, PGAR или FIAF, но был переименован в ANGPTL4.
Этот ген индуцируется в условиях гипоксии (с низким содержанием кислорода) в различных типах клеток и является мишенью рецепторов, активируемых пролифератором пероксисом . Кодируемый белок представляет собой гормон сыворотки, непосредственно участвующий в регуляции липидного обмена.
ANGPTL4 играет важную роль при многих видах рака и участвует в метастатическом процессе, модулируя проницаемость сосудов, подвижность раковых клеток и инвазивность.
Имя
Прежнее название FIAF расшифровывается как «фактор ожирения, вызванный голоданием».
Состав
Этот ген является членом семейства ангиопоэтин- подобных генов и кодирует гликозилированный секретируемый белок с N-концевым доменом спиральной спирали и фибриноген- подобным C-концевым доменом.
Выражение
У мышей самые высокие уровни экспрессии мРНК ANGPTL4 обнаруживаются в белой и коричневой жировой ткани, за которой следуют печень, почки, мышцы и кишечник. ANGPTL4 человека наиболее высоко экспрессируется в печени.
Функция
Этот ген индуцируется в условиях гипоксии (с низким содержанием кислорода) в различных типах клеток и является мишенью рецепторов, активируемых пролифератором пероксисом . Кодируемый белок представляет собой гормон сыворотки, непосредственно участвующий в регуляции липидного обмена. Нативный полноразмерный ANGPTL4 может образовывать структуры более высокого порядка через межмолекулярные дисульфидные связи. N-концевой регион ANGPTL4 (nANGPTL4) отвечает за его сборку. Полноразмерный ANGPTL4 подвергается протеолитическому расщеплению в линкерной области, высвобождая nANGPTL4 и мономерную С-концевую часть ANGPTL4 (cANGPTL4). NANGPTL4 и cANGPTL4 имеют разные биологические функции. Моноклональные антитела, нацеленные на nANGPTL4 и cANGPTL4, были разработаны для различения их функций.
Клиническое значение
ANGPTL4 играет важную роль при многих видах рака и участвует в метастатическом процессе, модулируя проницаемость сосудов, подвижность раковых клеток и инвазивность. ANGPTL4 способствует росту опухоли и защищает клетки от аноикиса , формы запрограммированной гибели клеток, вызываемой, когда контактно-зависимые клетки отслаиваются от окружающей тканевой матрицы. ANGPTL4, секретируемый опухолями, может связываться с интегринами , активируя последующую передачу сигналов и приводя к продукции супероксида, способствующего онкогенезу . ANGPTL4 разрушает соединения эндотелиальных клеток путем прямого взаимодействия с интегрином, VE-кадгерином и клаудином-5 последовательным образом, способствуя метастазированию . ANGPTL4, в частности C-концевой фрагмент (cANGPTL4), является ключевым игроком, который координирует увеличение потока клеточной энергии, критически важное для эпителиально-мезенхимального перехода (EMT), через сигнальную ось ANGPTL4: YWHAG (14-3-3γ). Ось передачи сигналов ANGPTL4: YWHAG придает метаболическую гибкость и повышает компетентность EMT за счет взаимодействия со специфическими сигналами фосфорилирования на целевых белках. Прямым следствием является то, что ANGPTL4 обеспечивает достаточную клеточную энергию для подпитки нескольких транспортеров ABC, чтобы обеспечить опосредованную ЕМТ химиорезистентность.
ANGPTL4 функционирует как матрицеклеточный белок, способствующий заживлению кожных ран. У мышей с дефицитом ANGPTL4 наблюдается отсроченная реэпителизация раны с нарушением миграции кератиноцитов , ангиогенезом и измененной воспалительной реакцией. ANGPTL4 индуцирует продукцию оксида азота посредством опосредованной интегрином / JAK / STAT3 активации экспрессии iNOS в эпителии раны и усиливает ангиогенез для ускорения заживления ран у мышей с диабетом. ANGPTL4 индуцирует опосредованную β-катенином повышающую регуляцию ID3 в фибробластах для снижения экспрессии коллагена в рубцах. ANGPTL4 способен реверсировать индуцированную дифференцировкой фибробластов и миофибробластов выровненные электроспряденные фиброзные субстраты. Циклическое растяжение фибробластов сухожилий человека стимулировало экспрессию и высвобождение белка ANGPTL4 посредством передачи сигналов TGF-β и HIF-1α, и высвобожденный ANGPTL4 был проангиогенным. ANGPTL4 также является мощным ангиогенным фактором, экспрессия которого повышается в гипоксических клетках Мюллера сетчатки in vitro и ишемической сетчатке in vivo. Экспрессия ANGPTL4 увеличивалась в водной и стекловидном теле пациентов с пролиферативной диабетической ретинопатией и локализовалась в областях неоваскуляризации сетчатки.
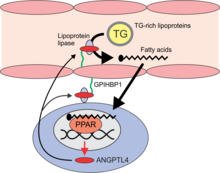
ANGPTL4 зарекомендовал себя как мощный ингибитор клиренса триглицеридов (ТГ) сыворотки , вызывающий повышение уровней ТГ в сыворотке за счет ингибирования фермента липопротеинлипазы (ЛПЛ). Биохимические исследования показывают, что ANGPTL4 отключает LPL частично за счет диссоциации каталитически активного димера LPL на неактивные мономеры LPL. Однако данные также предполагают, что ANGPTL4 действует как обычный неконкурентный ингибитор, который связывается с LPL, чтобы предотвратить гидролиз субстрата как часть обратимого механизма. Как следствие, мыши с нокаутом ANGPTL4 имеют пониженные уровни триглицеридов в сыворотке, тогда как противоположное верно для мышей, сверхэкспрессирующих ANGPTL4. ANGPTL4 подавляет образование ячеек пены, чтобы уменьшить развитие атеросклероза . Снижение активности LPL в жировой ткани во время голодания , вероятно, вызвано повышенной локальной продукцией ANGPTL4. В других тканях, таких как сердце, выработка ANGPTL4 стимулируется жирными кислотами и может служить для защиты клеток от избыточного поглощения жира. ANGPTL4 в большей степени индуцируется в мышцах, не выполняющих упражнения, чем в мышцах человека во время интенсивных упражнений. Предположительно, ANGPTL4 в мышцах, не занимающихся физической нагрузкой, приводит к снижению местного поглощения жирных кислот, производных триглицеридов плазмы, и их сохранению для использования при нагрузке на мышцы. Индукции ANGPTL4 в тренирующих мышцах, вероятно, противодействует подавляющая регуляция, опосредованная AMP-активируемой протеинкиназой (AMPK), что способствует использованию триглицеридов плазмы в качестве топлива для активных мышц.
Высокопроизводительное секвенирование РНК образцов легочной ткани от пандемии гриппа 1918 и 2009 годов показало, что ANGPTL4 был одним из наиболее значимо активированных генов. Инфекция легких мышиным гриппом стимулировала экспрессию ANGPTL4 через механизм, опосредованный STAT3. ANGPTL4 усиливал проницаемость легочной ткани и обострял повреждение легких, вызванное воспалением. У инфицированных гриппом мышей с нокаутом ANGPTL4 наблюдали меньшее повреждение легких и быстрее выздоравливали от инфекции по сравнению с мышами дикого типа. Лечение инфицированных мышей нейтрализующими антителами против ANGPTL4 значительно ускорило восстановление легких и улучшило целостность легочной ткани. Также было показано, что лечение антителами против ANGPTL4 уменьшает отек легких и травмы при вторичной пневмококковой пневмонии .
использованная литература
внешние ссылки
- Расположение генома человека ANGPTL4 и страница сведений о гене ANGPTL4 в браузере генома UCSC .
- Обзор всей структурной информации, доступной в PDB для UniProt : Q9BY76 ( ангиопоэтин -родственный белок 4) в PDBe-KB .
дальнейшее чтение
- Алекс С., Лихтенштейн Л., Дейк В., Менсинк Р.П., Тан Н.С., Керстен С. (апрель 2014 г.). «ANGPTL4 продуцируется энтероэндокринными клетками кишечного тракта человека». Гистохимия и клеточная биология . 141 (4): 383–91. DOI : 10.1007 / s00418-013-1157-у . PMID 24141811 . S2CID 15092480 .
- Grootaert C, Van de Wiele T, Verstraete W, Bracke M, Vanhoecke B (апрель 2012 г.). «Ангиопоэтин-подобный белок 4: воздействие на здоровье, модулирующие агенты и взаимосвязь структура-функция». Экспертный обзор протеомики . 9 (2): 181–99. DOI : 10.1586 / epr.12.12 . PMID 22462789 . S2CID 5242622 .
- Terada LS, Nwariaku FE (март 2011 г.). «Побег Anoikis через ROS: ANGPTL4 управляет передачей сигналов интегрина через Nox1» . Раковая клетка . 19 (3): 297–9. DOI : 10.1016 / j.ccr.2011.02.019 . PMID 21397852 .
- Пал М., Тан М.Дж., Хуанг Р.Л., Го Ю.Й., Ван XL, Тан МБ, Тан Н.С. (2011). «Ангиопоэтин-подобный 4 регулирует дифференцировку эпидермиса» . PLOS ONE . 6 (9): e25377. DOI : 10.1371 / journal.pone.0025377 . PMC 3178651 . PMID 21966511 .
- Lichtenstein L, Mattijssen F, de Wit NJ, Georgiadi A, Hooiveld GJ, van der Meer R, et al. (Декабрь 2010 г.). «Angptl4 защищает от тяжелых провоспалительных эффектов насыщенных жиров, ингибируя поглощение жирных кислот макрофагами брыжеечных лимфатических узлов» . Клеточный метаболизм . 12 (6): 580–92. DOI : 10.1016 / j.cmet.2010.11.002 . PMC 3387545 . PMID 21109191 .
- Лихтенштейн Л., Бербе Дж. Ф., ван Дейк С. Дж., Ван Дейк К. В., Бенсадун А., Кема И. П. и др. (Ноябрь 2007 г.). «Angptl4 усиливает синтез холестерина в печени посредством ингибирования LPL- и HL-зависимого поглощения холестерина печенью» . Артериосклероз, тромбоз и биология сосудов . 27 (11): 2420–7. DOI : 10.1161 / ATVBAHA.107.151894 . PMID 17761937 .
- Керстен С. (ноябрь 2005 г.). «Регулирование липидного обмена с помощью ангиопоэтин-подобных белков». Труды биохимического общества . 33 (Pt 5): 1059–62. DOI : 10.1042 / BST20051059 . PMID 16246045 .
- Ле Ян С., Эми К., Казес А., Монно С., Ламанде Н., Фавье Дж. И др. (Май 2003 г.). «Ангиопоэтин-подобный 4 представляет собой проангиогенный фактор, продуцируемый во время ишемии и обычной почечно-клеточной карциномы» . Американский журнал патологии . 162 (5): 1521–8. DOI : 10.1016 / S0002-9440 (10) 64285-X . PMC 1851201 . PMID 12707035 .
- Мандард С., Зандберген Ф., Тан Н.С., Эшер П., Пацурис Д., Кениг В. и др. (Август 2004 г.). «Прямой рецептор, активируемый пролифератором пероксисом, нацелен на жировой фактор, индуцированный натощак (FIAF / PGAR / ANGPTL4), присутствует в плазме крови в виде усеченного белка, содержание которого увеличивается при лечении фенофибратом» . Журнал биологической химии . 279 (33): 34411–20. DOI : 10.1074 / jbc.M403058200 . PMID 15190076 .
- Xu A, Lam MC, Chan KW, Wang Y, Zhang J, Hoo RL и др. (Апрель 2005 г.). «Ангиопоэтин-подобный белок 4 снижает уровень глюкозы в крови и улучшает толерантность к глюкозе, но вызывает гиперлипидемию и стеатоз печени у мышей» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (17): 6086–91. DOI : 10.1073 / pnas.0408452102 . PMC 1087912 . PMID 15837923 .
- Германн Л.М., Пинкертон М., Дженнингс К., Ян Л., Гром А., Соудерс Д. и др. (Апрель 2005 г.). «Ангиопоэтин-подобный-4 является потенциальным ангиогенным медиатором при артрите». Клиническая иммунология . 115 (1): 93–101. DOI : 10.1016 / j.clim.2004.12.002 . PMID 15870027 .
- Чжан Р. (апрель 2016 г.). «Модель ANGPTL3-4-8, молекулярный механизм для переноса триглицеридов» . Открытая биология . 6 (4): 150272. DOI : 10.1098 / rsob.150272 . PMC 4852456 . PMID 27053679 .