Оксид олова (II) - Tin(II) oxide
|
|

|
|

|
|
| Имена | |
|---|---|
|
Название ИЮПАК
Оксид олова (II)
|
|
| Другие имена
Оксид олова, оксид олова
|
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ECHA InfoCard |
100.040.439 |
| Номер ЕС | |
|
PubChem CID
|
|
| Номер RTECS | |
| UNII | |
|
Панель управления CompTox ( EPA )
|
|
|
|
|
|
| Характеристики | |
| SnO | |
| Молярная масса | 134,709 г / моль |
| Появление | черный или красный порошок в безводном состоянии, белый в гидратированном виде |
| Плотность | 6,45 г / см 3 |
| Температура плавления | 1080 ° С (1,980 ° F, 1350 К) |
| нерастворимый | |
| −19,0 · 10 −6 см 3 / моль | |
| Состав | |
| четырехугольный | |
| Термохимия | |
|
Стандартная мольная
энтропия ( S |
56 Дж · моль −1 · K −1 |
|
Std энтальпия
формации (Δ F H ⦵ 298 ) |
−285 кДж · моль −1 |
| Опасности | |
| Паспорт безопасности | ICSC 0956 |
| точка возгорания | Не воспламеняется |
| NIOSH (пределы воздействия на здоровье в США): | |
|
PEL (Допустимо)
|
никто |
|
REL (рекомендуется)
|
TWA 2 мг / м 3 |
|
IDLH (Непосредственная опасность)
|
ND |
| Родственные соединения | |
|
Другие анионы
|
Сульфид олова Селенид олова Теллурид олова |
|
Другие катионы
|
Окись углерода Оксид кремния Оксид германия (II) Оксид свинца (II) |
| Диоксид олова | |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Оксид олова (II) ( оксид олова ) представляет собой соединение с формулой SnO. Он состоит из олова и кислорода, причем олово имеет степень окисления +2. Есть две формы: стабильная сине-черная форма и метастабильная красная форма.
Подготовка и реакции
Сине-черный SnO может быть получен путем нагревания гидрата оксида олова (II) SnO · xH 2 O (x <1), осажденного при взаимодействии соли олова (II) с гидроксидом щелочного металла, таким как NaOH.
Метастабильный красный SnO может быть получен путем осторожного нагревания осадка, образованного действием водного раствора аммиака на соль олова (II).
SnO можно получить в виде чистого вещества в лаборатории путем контролируемого нагревания оксалата олова (II) ( оксалата олова ) в отсутствие воздуха или в атмосфере CO 2 . Этот метод также применяется для производства закиси железа и окиси марганца .
- SnC 2 O 4 · 2H 2 O → SnO + CO 2 + CO + 2 H 2 O
Оксид олова (II) горит на воздухе тусклым зеленым пламенем с образованием SnO 2 .
- 2 SnO + O 2 → 2 SnO 2
При нагревании в инертной атмосфере сначала происходит диспропорционирование с образованием металлического Sn и Sn 3 O 4, которые в дальнейшем вступают в реакцию с образованием SnO 2 и металлического Sn.
- 4SnO → Sn 3 O 4 + Sn
- Sn 3 O 4 → 2SnO 2 + Sn
SnO является амфотерным , растворяется в сильной кислоте с образованием солей олова (II) и в сильном основании с образованием станнитов, содержащих Sn (OH) 3 - . Его можно растворить в сильнокислых растворах с образованием ионных комплексов Sn (OH 2 ) 3 2+ и Sn (OH) (OH 2 ) 2 + , а в менее кислых растворах - с образованием Sn 3 (OH) 4 2+ . Обратите внимание, что также известны безводные станниты, например K 2 Sn 2 O 3 , K 2 SnO 2 . SnO является восстановителем и, как считается, восстанавливает медь (I) до металлических кластеров при производстве так называемого «медно-рубинового стекла».
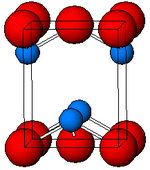
Состав
Черный, α-SnO имеет структуру тетрагонального слоя PbO, содержащего четыре координатных квадратных пирамидальных атома олова. Эта форма встречается в природе как редкий минерал ромархит . Асимметрию обычно просто приписывают стерически активной неподеленной паре; однако расчеты электронной плотности показывают, что асимметрия вызвана разрыхляющим взаимодействием Sn (5s) и O (2p) орбиталей. Электронная структура и химический состав неподеленной пары определяют большинство свойств материала.
В SnO наблюдается нестехиометрия.
Ширина запрещенной зоны электронов составляет от 2,5 до 3 эВ .
Использует
Оксид двухвалентного олова в основном используется в качестве прекурсора при производстве других, обычно двухвалентных, соединений или солей олова. Оксид олова также можно использовать в качестве восстановителя и при создании рубинового стекла . Он редко используется в качестве катализатора этерификации .
Оксид церия (III) в керамической форме вместе с оксидом олова (II) (SnO) используется для освещения УФ-светом.

