Сверхкритическая жидкость - Supercritical fluid
Сверхкритической жидкости ( SCF ) представляет собой любое вещество при температуре и давлении выше его критической точки , где различные жидкие и газовые фазы не существует, но ниже давления требуется , чтобы сжать его в твердое вещество . Он может истекать через пористые твердые тела, как газ, преодолевая ограничения массопереноса, которые замедляют перенос жидкости через такие материалы. SCF намного превосходит газы по способности растворять такие материалы, как жидкости или твердые тела. Кроме того, вблизи критической точки небольшие изменения давления или температуры приводят к большим изменениям плотности , что позволяет «отрегулировать» многие свойства сверхкритической жидкости.
Сверхкритические текучие среды происходят в атмосфере в газовых гигантов Юпитера и Сатурна , на земной планете Венера , и , вероятно , в тех , из ледяных гигантов Уран и Нептун . На Земле есть вода в сверхкритическом состоянии , такая как вода, исходящая от черных курильщиков , что-то вроде подводного гидротермального источника . Они используются в качестве заменителя органических растворителей в различных промышленных и лабораторных процессах. Двуокись углерода и вода - наиболее часто используемые сверхкритические жидкости; они часто используются для удаления кофеина и выработки электроэнергии соответственно.
Характеристики
В общем, сверхкритические флюиды обладают свойствами между газом и жидкостью. В таблице 1 показаны критические свойства некоторых веществ, которые обычно используются в качестве сверхкритических жидкостей.
| Растворитель | Молекулярная масса | Критическая температура | Критическое давление | Критическая плотность |
|---|---|---|---|---|
| г / моль | K | МПа ( атм ) | г / см 3 | |
| Углекислый газ (CO 2 ) | 44,01 | 304,1 | 7,38 (72,8) | 0,469 |
| Вода (H 2 O) † | 18,015 | 647,096 | 22,064 (217,755) | 0,322 |
| Метан (CH 4 ) | 16.04 | 190,4 | 4,60 (45,4) | 0,162 |
| Этан (C 2 H 6 ) | 30.07 | 305,3 | 4,87 (48,1) | 0,203 |
| Пропан (C 3 H 8 ) | 44,09 | 369,8 | 4,25 (41,9) | 0,217 |
| Этилен (C 2 H 4 ) | 28.05 | 282,4 | 5,04 (49,7) | 0,215 |
| Пропилен (C 3 H 6 ) | 42,08 | 364,9 | 4,60 (45,4) | 0,232 |
| Метанол (CH 3 OH) | 32,04 | 512,6 | 8,09 (79,8) | 0,272 |
| Этанол (C 2 H 5 OH) | 46,07 | 513,9 | 6,14 (60,6) | 0,276 |
| Ацетон (C 3 H 6 O) | 58,08 | 508,1 | 4,70 (46,4) | 0,278 |
| Закись азота (N 2 O) | 44,013 | 306,57 | 7,35 (72,5) | 0,452 |
† Источник: Международная ассоциация свойств воды и пара ( IAPWS ).
В таблице 2 показаны плотность, коэффициент диффузии и вязкость для типичных жидкостей, газов и сверхкритических жидкостей.
| Плотность (кг / м 3 ) | Вязкость ( мкПа · с ) | Коэффициент диффузии (мм 2 / с) | |
|---|---|---|---|
| Газы | 1 | 10 | 1–10 |
| Сверхкритические жидкости | 100–1000 | 50–100 | 0,01–0,1 |
| Жидкости | 1000 | 500–1000 | 0,001 |
Кроме того, в сверхкритической жидкости отсутствует поверхностное натяжение , так как отсутствует граница фаз жидкость / газ. Изменяя давление и температуру текучей среды, ее свойства можно «настроить» так, чтобы они стали более похожими на жидкость или более газообразными. Одно из важнейших свойств - растворимость материала в жидкости. Растворимость в сверхкритической жидкости имеет тенденцию увеличиваться с увеличением плотности жидкости (при постоянной температуре). Поскольку плотность увеличивается с давлением, растворимость имеет тенденцию к увеличению с давлением. Взаимосвязь с температурой немного сложнее. При постоянной плотности растворимость увеличивается с температурой. Однако вблизи критической точки плотность может резко упасть при небольшом повышении температуры. Поэтому вблизи критической температуры растворимость часто падает с повышением температуры, а затем снова возрастает.
Смеси
Обычно сверхкритические жидкости полностью смешиваются друг с другом, так что бинарная смесь образует единую газовую фазу, если критическая точка смеси превышена. Однако известны исключения в системах, в которых один компонент намного более летуч, чем другой, которые в некоторых случаях образуют две несмешивающиеся газовые фазы при высоком давлении и температурах выше критических точек компонентов. Такое поведение было обнаружено, например, в системах N 2 -NH 3 , NH 3 -CH 4 , SO 2 -N 2 и н-бутан-H 2 O.
Критическую точку бинарной смеси можно оценить как среднее арифметическое критических температур и давлений двух компонентов,
Для большей точности критическая точка может быть рассчитана с использованием уравнений состояния , таких как Пенга-Робинсона , или методов группового вклада . Другие свойства, такие как плотность, также можно рассчитать с помощью уравнений состояния.
Фазовая диаграмма
На рисунках 1 и 2 показаны двумерные проекции фазовой диаграммы . На фазовой диаграмме давление-температура (рис. 1) кривая кипения разделяет газовую и жидкую области и заканчивается в критической точке, где жидкая и газовая фазы исчезают, становясь единой сверхкритической фазой.
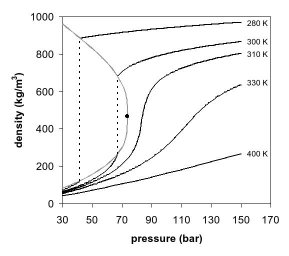
Появление единой фазы можно наблюдать и на фазовой диаграмме плотность - давление для диоксида углерода (рис. 2). При температуре значительно ниже критической, например 280 K, по мере увеличения давления газ сжимается и в конечном итоге (при давлении чуть более 40 бар ) конденсируется в гораздо более плотную жидкость, что приводит к разрыву линии (вертикальная пунктирная линия). Система состоит из 2 фаз, находящихся в равновесии , плотной жидкости и газа низкой плотности. По мере приближения к критической температуре (300 К) плотность газа в состоянии равновесия становится выше, а жидкости - ниже. В критической точке (304,1 К и 7,38 МПа (73,8 бар)) нет разницы в плотности, и две фазы становятся одной жидкой фазой. Таким образом, выше критической температуры газ нельзя сжижать под давлением. При температуре немного выше критической (310 К), вблизи критического давления линия почти вертикальна. Небольшое увеличение давления вызывает большое увеличение плотности сверхкритической фазы. Многие другие физические свойства также показывают большие градиенты давления вблизи критической точки, например вязкость , относительная диэлектрическая проницаемость и сила растворителя, которые все тесно связаны с плотностью. При более высоких температурах жидкость начинает вести себя больше как идеальный газ с более линейным соотношением плотность / давление, как видно на рисунке 2. Для диоксида углерода при 400 К плотность увеличивается почти линейно с давлением.
Многие сжатые газы на самом деле являются сверхкритическими жидкостями. Например, у азота есть критическая точка 126,2 К (-147 ° C) и 3,4 МПа (34 бар). Следовательно, азот (или сжатый воздух) в газовом баллоне с давлением выше этого давления на самом деле является сверхкритической жидкостью. Их чаще называют постоянными газами. При комнатной температуре они намного выше своей критической температуры и, следовательно, ведут себя как почти идеальный газ, подобно CO 2 при температуре выше 400 K. Однако их нельзя сжижать под действием механического давления, если они не охлаждаются ниже их критической температуры, что требует гравитационного давления, такого как внутри газовых гигантов, для получения жидкости или твердого тела при высоких температурах. Выше критической температуры повышенное давление может увеличить плотность до такой степени, что SCF покажет плотность и поведение жидкости, как у жидкости. При очень высоких давлениях SCF может быть сжат в твердое тело, потому что кривая плавления простирается вправо от критической точки на фазовой диаграмме P / T. В то время как давление, необходимое для сжатия сверхкритического CO 2 в твердое вещество, в зависимости от температуры может составлять всего 570 МПа, необходимое для затвердевания воды в сверхкритическом состоянии составляет 14000 МПа.
Линия Фишера-Видома , то линия Видома , или линия Я.И. термодинамические понятия , которые позволяют отличить жидкость-газ , как и подобные состояния в сверхкритической текучей среде.
В последние годы значительные усилия были посвящены исследованию различных свойств сверхкритических жидкостей. Это захватывающая область с долгой историей с 1822 года, когда барон Чарльз Канььяр де ла Тур открыл сверхкритические жидкости, проводя эксперименты, связанные с неоднородностями звука в герметичном стволе пистолета, заполненном различными жидкостями при высокой температуре. В последнее время сверхкритические жидкости нашли применение в самых разных областях, от экстракции цветочного аромата из цветов до приложений в пищевой науке, таких как создание кофе без кофеина, функциональных пищевых ингредиентов, фармацевтических препаратов, косметики, полимеров, порошков, био- и функциональных продуктов. материалы, наносистемы, натуральные продукты, биотехнологии, ископаемое и биотопливо, микроэлектроника, энергия и окружающая среда. Во многом ажиотаж и интерес последнего десятилетия вызваны огромным прогрессом, достигнутым в увеличении мощности соответствующих экспериментальных инструментов. Разработка новых экспериментальных методов и улучшение существующих продолжает играть важную роль в этой области, при этом недавние исследования сосредоточены на динамических свойствах жидкостей.
Естественное явление
Гидротермальная циркуляция

Гидротермальная циркуляция происходит в земной коре, где жидкость нагревается и начинает конвекцию. Считается, что эти жидкости достигают сверхкритических условий при различных условиях, таких как образование медно-порфировых отложений или высокотемпературная циркуляция морской воды на морском дне. На срединно-океанических хребтах эта циркуляция наиболее очевидна по появлению гидротермальных источников, известных как «черные курильщики». Это большие (метровые) дымовые трубы сульфидных и сульфатных минералов, которые выводят флюиды с температурой до 400 ° C. Жидкости выглядят как большие черные клубящиеся облака дыма из-за осаждения растворенных металлов в жидкости. Вполне вероятно, что на глубине многие из этих выходных участков достигают сверхкритических условий, но большинство из них достаточно охлаждается к тому времени, когда они достигают морского дна, чтобы стать докритическими. Одно конкретное место выхода, Turtle Pits, показало кратковременный период сверхкритичности в месте выхода. Предполагается, что еще одно место, Биби , в Каймановом желобе, демонстрирует устойчивую сверхкритичность в вентиляционном отверстии.
Планетарные атмосферы
Атмосфера Венеры на 96,5% состоит из углекислого газа и на 3,5% из азота. Поверхностное давление составляет 9,3 МПа (93 бара), а температура поверхности составляет 735 К, что выше критических точек обоих основных компонентов и делает приземную атмосферу сверхкритической жидкостью.
Внутренние атмосферы газовых планет-гигантов Солнечной системы состоят в основном из водорода и гелия при температурах, значительно превышающих их критические точки. Газообразные внешние атмосферы Юпитера и Сатурна плавно переходят в плотную жидкую внутреннюю часть, в то время как природа переходных зон Нептуна и Урана неизвестна. Теоретические модели внесолнечной планеты Gliese 876d постулировали океан сверхкритической жидкой воды под давлением со слоем твердого водяного льда под высоким давлением на дне.
Приложения
Сверхкритическая флюидная экстракция
Преимущества сверхкритической жидкостной экстракции (по сравнению с жидкостной экстракцией) заключаются в том, что она относительно быстрая из-за низкой вязкости и высокой диффузионной способности, связанной со сверхкритическими жидкостями. Экстракция может быть до некоторой степени избирательной, контролируя плотность среды, и экстрагированный материал легко извлекается путем простого сброса давления, позволяя сверхкритической текучей среде вернуться в газовую фазу и испариться, оставляя мало остатков растворителя или не оставляя их совсем. Двуокись углерода - самый распространенный сверхкритический растворитель. Он широко используется для удаления кофеина из зеленых кофейных зерен, экстракции хмеля для производства пива, а также для производства эфирных масел и фармацевтических продуктов из растений. Некоторые методы лабораторных испытаний включают использование сверхкритической жидкостной экстракции в качестве метода экстракции вместо использования традиционных растворителей .
Разложение сверхкритической жидкости
Сверхкритическая вода может использоваться для разложения биомассы посредством сверхкритической водной газификации биомассы. Этот тип газификации биомассы может использоваться для производства углеводородного топлива для использования в эффективном устройстве для сжигания или для производства водорода для использования в топливном элементе. В последнем случае выход водорода может быть намного выше, чем содержание водорода в биомассе из-за парового риформинга, когда вода является участником, обеспечивающим водород в общей реакции.
Сухая чистка
Сверхкритический диоксид углерода (SCD) можно использовать вместо PERC ( перхлорэтилена ) или других нежелательных растворителей для химической чистки . Сверхкритические иногда двуокиси углерода встраивается в кнопки, и, когда SCD сбрасывают, кнопки поп, или развалится. Моющие средства, растворимые в диоксиде углерода, улучшают растворяющую способность растворителя. В оборудовании для химической чистки на основе CO 2 используется жидкий CO 2 , а не сверхкритический CO 2 , чтобы избежать повреждения кнопок.
Сверхкритическая жидкостная хроматография
Сверхкритическая жидкостная хроматография (SFC) может использоваться в аналитических масштабах, где она сочетает в себе многие преимущества высокоэффективной жидкостной хроматографии (ВЭЖХ) и газовой хроматографии (ГХ). Его можно использовать с нелетучими и термолабильными аналитами (в отличие от ГХ) и с универсальным пламенно-ионизационным детектором (в отличие от ВЭЖХ), а также для получения более узких пиков из-за быстрой диффузии. На практике преимуществ, предлагаемых SFC, было недостаточно, чтобы заменить широко используемые ВЭЖХ и ГХ, за исключением нескольких случаев, таких как хиральное разделение и анализ высокомолекулярных углеводородов. Для производства доступны эффективные препаративные модели с движущимся слоем . Чистота конечных продуктов очень высока, но стоимость делает их пригодными только для очень ценных материалов, таких как фармацевтические препараты.
Химические реакции
Изменение условий реакционного растворителя может позволить разделить фазы для удаления продукта или одну фазу для реакции. Быстрая диффузия ускоряет контролируемые диффузией реакции. Температура и давление могут регулировать реакцию по предпочтительным направлениям, например, для улучшения выхода конкретного хирального изомера . Есть также значительные экологические преимущества по сравнению с обычными органическими растворителями. Промышленные синтезы, которые выполняются в сверхкритических условиях, включают синтез полиэтилена из сверхкритического этена , изопропилового спирта из сверхкритического пропена , 2-бутанола из сверхкритического бутена и аммиака из сверхкритической смеси азота и водорода . Другие реакции в прошлом проводились в промышленных масштабах в сверхкритических условиях, включая синтез метанола и термический (некаталитический) крекинг масла. Благодаря разработке эффективных катализаторов , требуемые температуры этих двух процессов были снижены и больше не являются сверхкритическими.
Пропитка и крашение
Пропитка, по сути, обратная экстракция. Вещество растворяется в сверхкритической жидкости, раствор протекает мимо твердой подложки и осаждается на подложке или растворяется в ней. Окрашивание, которое легко выполняется на полимерных волокнах, таких как полиэфир, с использованием дисперсных (неионных) красителей , является частным случаем этого. Двуокись углерода также растворяется во многих полимерах, значительно набухая и пластифицируя их, что еще больше ускоряет процесс диффузии.
Формирование нано- и микрочастиц
Образование мелких частиц вещества с узким гранулометрическим составом - важный процесс в фармацевтической и других отраслях промышленности. Сверхкритические жидкости предоставляют ряд способов достижения этого путем быстрого превышения точки насыщения растворенного вещества путем разбавления, сброса давления или их комбинации. Эти процессы происходят быстрее в сверхкритических жидкостях, чем в жидкостях, способствуя зародышеобразованию или спинодальному распаду по сравнению с ростом кристаллов и давая очень маленькие частицы правильного размера. Последние сверхкритические жидкости показали способность уменьшать количество частиц в диапазоне от 5 до 2000 нм.
Создание фармацевтических сокристаллов
Сверхкритические жидкости действуют как новая среда для генерации новых кристаллических форм API (активных фармацевтических ингредиентов), называемых фармацевтическими сокристаллами. Технология сверхкритических жидкостей предлагает новую платформу, которая позволяет за один этап генерировать частицы, которые трудно или даже невозможно получить традиционными методами. Генерация чистых и высушенных новых сокристаллов (кристаллических молекулярных комплексов, содержащих API и один или несколько конформеров в кристаллической решетке) может быть достигнута благодаря уникальным свойствам SCF за счет использования различных свойств сверхкритических флюидов: сверхкритической растворяющей способности CO 2 , антирастворителя. эффект и усиление его распыления.
Сверхкритическая сушка
Сверхкритическая сушка - это метод удаления растворителя без эффектов поверхностного натяжения. По мере высыхания жидкости поверхностное натяжение распространяется на небольшие структуры внутри твердого тела, вызывая деформацию и усадку. В сверхкритических условиях поверхностное натяжение отсутствует, и сверхкритическая жидкость может быть удалена без искажения. Сверхкритическая сушка используется в процессе производства аэрогелей и сушки хрупких материалов, таких как археологические образцы и биологические образцы для электронной микроскопии .
Сверхкритическое водное окисление
В сверхкритическом водном окислении вода в сверхкритическом состоянии используется в качестве среды для окисления опасных отходов, что исключает образование токсичных продуктов сгорания, которые могут образовываться при горении.
Окисляемые отходы растворяются в сверхкритической воде вместе с молекулярным кислородом (или окислителем, который отдает кислород при разложении, например, перекисью водорода ), в этот момент происходит реакция окисления.
Сверхкритический водный гидролиз
Сверхкритический гидролиз - это метод преобразования всех полисахаридов биомассы, а также связанного с ними лигнина в низкомолекулярные соединения путем контактирования только с водой в сверхкритических условиях. Сверхкритическая вода действует как растворитель, поставщик тепловой энергии, разрушающей связи, теплоноситель и источник атомов водорода. Все полисахариды превращаются в простые сахара с почти количественным выходом за секунду или меньше. Алифатические межкольцевые связи лигнина также легко расщепляются на свободные радикалы, которые стабилизируются водородом из воды. Ароматические кольца лигнина не подвергаются влиянию при коротком времени реакции, так что продукты, полученные из лигнина, представляют собой смешанные фенолы с низкой молекулярной массой. Чтобы воспользоваться преимуществом очень короткого времени реакции, необходимого для расщепления, необходимо разработать систему непрерывной реакции. Тем самым сводится к минимуму количество воды, нагретой до сверхкритического состояния.
Сверхкритическая водная газификация
Сверхкритическая водная газификация - это процесс использования положительного эффекта сверхкритической воды для преобразования водных потоков биомассы в чистую воду и газы, такие как H 2 , CH 4 , CO 2 , CO и т. Д.
Сверхкритическая жидкость в энергетике
КПД из теплового двигателя , в конечном счете зависит от разности температур между источником тепла и раковиной ( цикла Карно ). Для повышения эффективности электростанций рабочая температура должна быть повышена. Используя воду в качестве рабочего тела, это переводит ее в сверхкритические условия. Эффективность может быть увеличена примерно с 39% для субкритических операций до примерно 45% с использованием современных технологий. Реакторы со сверхкритической водой (SCWR) являются многообещающими передовыми ядерными системами, которые обеспечивают аналогичный прирост теплового КПД. Двуокись углерода также может использоваться на атомных электростанциях сверхкритического цикла с аналогичным увеличением эффективности. Многие сверхкритические парогенераторы , работающие на угле, работают по всему миру и повысили эффективность традиционных паровых электростанций.
Производство биодизеля
Превращение растительного масла в биодизельное топливо происходит посредством реакции переэтерификации , где триглицерид превращается в метиловый эфир плюс глицерин . Обычно это делается с использованием метанола и щелочных или кислотных катализаторов, но может быть достигнуто с использованием сверхкритического метанола без катализатора. Метод использования сверхкритического метанола для производства биодизеля впервые был изучен Сакой и его сотрудниками. Это имеет то преимущество, что позволяет использовать более широкий диапазон и содержание воды в сырье (в частности, в отработанном кулинарном масле), продукт не нужно промывать для удаления катализатора, и его легче спроектировать как непрерывный процесс.
Повышение нефтеотдачи, улавливания и хранения углерода
Сверхкритический диоксид углерода используется для увеличения нефтеотдачи на зрелых нефтяных месторождениях. В то же время существует возможность использования « чистой угольной технологии » для сочетания методов повышения нефтеотдачи с улавливанием углерода . CO 2 отделяется от других дымовых газов , сжимается до сверхкритического состояния и закачивается в геологическое хранилище, возможно, в существующие нефтяные месторождения для повышения урожайности.
В настоящее время только схемы выделения ископаемого CO 2 из природного газа фактически используют хранение углерода (например, газовое месторождение Слейпнера ), но есть много планов относительно будущих схем CCS с использованием CO 2 до или после сжигания . Существует также возможность уменьшить количество CO 2 в атмосфере за счет использования биомассы для выработки энергии и улавливания производимого CO 2 .
Усовершенствованная геотермальная система
Использование сверхкритического диоксида углерода вместо воды было исследовано в качестве геотермальной рабочей жидкости.
Холодильное оборудование
Сверхкритический диоксид углерода также становится полезным высокотемпературным хладагентом , который используется в новых домашних тепловых насосах без CFC / HFC, использующих транскритический цикл . Эти системы постоянно развиваются, и тепловые насосы для сверхкритического диоксида углерода уже успешно продаются в Азии. Системы EcoCute из Японии - одни из первых коммерчески успешных высокотемпературных тепловых насосов для бытовой воды.
Осаждение сверхкритической жидкости
Сверхкритические жидкости можно использовать для осаждения функциональных наноструктурированных пленок и наноразмерных частиц металлов на поверхности. Высокие коэффициенты диффузии и концентрации прекурсора в жидкости по сравнению с вакуумными системами, используемыми при химическом осаждении из паровой фазы, позволяют осаждению происходить в режиме с ограниченной скоростью реакции на поверхности, обеспечивая стабильный и равномерный межфазный рост. Это имеет решающее значение для разработки более мощных электронных компонентов, и металлические частицы, нанесенные таким образом, также являются мощными катализаторами химического синтеза и электрохимических реакций. Кроме того, из-за высоких скоростей переноса прекурсора в растворе можно покрывать частицы с большой площадью поверхности, которые при химическом осаждении из паровой фазы будут демонстрировать истощение вблизи выхода из системы, а также могут привести к нестабильным поверхностным поверхностям роста, таким как дендриты. . В результате получаются очень тонкие и однородные пленки, осаждаемые со скоростью, намного большей, чем осаждение атомных слоев , что является лучшим другим инструментом для покрытия частиц в этом масштабе.
Антимикробные свойства
CO 2 при высоких давлениях обладает антимикробными свойствами. Хотя его эффективность была продемонстрирована для различных применений, механизмы инактивации до конца не изучены, хотя их исследовали более 60 лет.
История
В 1822 году барон Шарль Каньяр де ла Тур обнаружил критическую точку вещества в своих знаменитых экспериментах с пушечным стволом. Слушая прерывистые звуки катящегося кремневого шара в герметичной пушке, наполненной жидкостями при различных температурах, он наблюдал критическую температуру. Выше этой температуры плотности жидкой и газовой фаз становятся равными, и различие между ними исчезает, что приводит к единой сверхкритической жидкой фазе.
Смотрите также
- Сверхкритическая адсорбция
- Транскритический цикл
- Критическая точка (термодинамика)
- Проект глубокого бурения в Исландии
использованная литература
дальнейшее чтение
- Бруннер, Г. (2010). «Применение сверхкритических жидкостей». Ежегодный обзор химической и биомолекулярной инженерии . 1 : 321–342. DOI : 10,1146 / annurev-chembioeng-073009-101311 . PMID 22432584 .
внешние ссылки
-
Удобный калькулятор плотности, энтальпии, энтропии и других термодинамических данных сверхкритического CO
2 / вода и другие - видеоролики, чтобы представить критическую точку сверхкритической жидкости и растворимость в сверхкритической жидкости
- ОБНАРУЖЕН NewScientist Environment: самая горячая вода на Земле
- Поляков, Мартын (28 апреля 2008 г.). «Сверхкритические жидкости» . Пробирка . Brady Харан для Ноттингемского университета .