Сольвеевский процесс - Solvay process
Процесс Solvay или аммиачно-содовый процесс является основным промышленным процессом производства карбоната натрия (кальцинированной соды, Na 2 CO 3 ). Аммиачно-содовый процесс был разработан в его современной форме бельгийским химиком Эрнестом Сольвеем в 1860-х годах. Ингредиенты для этого легко доступны и недороги: соляной раствор (из внутренних источников или из моря) и известняк (из карьеров). Мировое производство кальцинированной соды в 2005 году оценивается в 42 миллиона тонн, что составляет более шести килограммов (13 фунтов) в год на каждого человека на Земле. Химические заводы, расположенные в Сольве, в настоящее время производят примерно три четверти этого объема, а оставшаяся часть добывается из природных месторождений. Этот метод заменил процесс Леблана .
История
Название «кальцинированная сода» основано на основном историческом методе получения щелочи, который заключался в использовании воды для извлечения ее из пепла определенных растений. В результате пожаров на дровах образовался калий и его основной компонент - карбонат калия (K 2 CO 3 ), тогда как из золы этих специальных заводов образовалась «кальцинированная сода» и ее преобладающий ингредиент - карбонат натрия (Na 2 CO 3 ). Слово «сода» (от среднелатинского) первоначально относилось к некоторым растениям, которые растут в растворах соли; было обнаружено, что пепел этих растений дает полезную кальцинированную соду. Выращивание таких растений достигло особенно высокого уровня развития в 18 веке в Испании, где растения получили название баррильи ; английское слово - « барилла ». Из золы водорослей также образуется кальцинированная сода, которая была основой огромной промышленности 18 века в Шотландии. Щелочь также добывали из высохших озер в Египте.
К концу 18 века этих источников было недостаточно для удовлетворения растущего спроса Европы на щелочь для производства мыла, текстиля и стекла. В 1791 году французский врач Николя Леблан разработал метод производства кальцинированной соды с использованием соли, известняка , серной кислоты и угля . Хотя процесс Леблана стал доминировать в производстве щелочи в начале 19 века, стоимость его вводимых ресурсов и загрязняющих побочных продуктов (включая газообразный хлористый водород ) показала, что это далеко не идеальное решение.
Сообщалось, что в 1811 году французский физик Огюстен Жан Френель обнаружил, что бикарбонат натрия осаждается, когда углекислый газ пропускают через солевые растворы, содержащие аммиак, что является центральной химической реакцией процесса Сольве. Открытие не было опубликовано. Как отмечал Десмонд Рейли, «История эволюции аммонийно-содового процесса является интересным примером того, как открытие может быть сделано, а затем отложено и не применено в течение значительного времени после этого». Серьезное рассмотрение этой реакции как основы промышленного процесса восходит к британскому патенту, выданному в 1834 г. Х. Г. Дьяру и Дж. Хеммингу. Было несколько попыток уменьшить эту реакцию на производственную практику, но с переменным успехом.
В 1861 году бельгийский промышленный химик Эрнест Сольвей обратил свое внимание на эту проблему; он, по-видимому, в значительной степени не знал об обширной более ранней работе. Его решение - 24-метровая газопоглощающая башня, в которой углекислый газ барботирует через нисходящий поток рассола. Это, вместе с эффективной рекуперацией и рециркуляцией аммиака, оказалось эффективным. К 1864 году Сольвей и его брат Альфред получили финансовую поддержку и построили завод в Куийе , сегодня пригород бельгийского города Шарлеруа . Новый процесс оказался более экономичным и менее загрязняющим, чем метод Леблана, и его использование распространилось. В 1874 году Solvays расширили свои производственные мощности, открыв новый, более крупный завод в Нанси , Франция.
В том же году Людвиг Монд посетил Solvay в Бельгии и получил права на использование новой технологии. Он и Джон Бруннер основали фирму Brunner, Mond & Co. и построили завод Solvay в Виннингтоне , недалеко от Нортвича , Чешир , Англия. Завод начал работать в 1874 году. Монд сыграл важную роль в коммерческом успехе процесса Solvay. В период с 1873 по 1880 год он внес несколько усовершенствований, удалив побочные продукты, которые могли замедлить или остановить процесс.
В 1884 году братья Солвей лицензировали американцев Уильяма Б. Когсвелла и Роуленда Хазарда на производство кальцинированной соды в США и создали совместное предприятие ( Solvay Process Company ) для строительства и эксплуатации завода в Солве, штат Нью-Йорк .

К 1890-м годам заводы Solvay-процесса производили большую часть мировой кальцинированной соды.
В 1938 году у реки Грин-Ривер в Вайоминге были обнаружены большие залежи минерала троны, из которых карбонат натрия можно добыть дешевле, чем добыть с помощью этого процесса. После закрытия первоначального завода Solvay, Нью-Йорк в 1986 году, в Северной Америке больше не было заводов Solvay . Во всем остальном мире процесс Solvay остается основным источником кальцинированной соды.
Химия
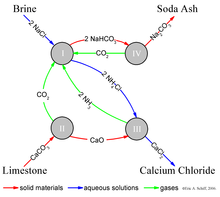
Процесс Solvay приводит к получению кальцинированной соды (преимущественно карбоната натрия (Na 2 CO 3 )) из рассола (в качестве источника хлорида натрия (NaCl)) и из известняка (в качестве источника карбоната кальция (CaCO 3 )). Общий процесс:
Реальная реализация этой глобальной общей реакции сложна. Упрощенное описание может быть дано с использованием четырех различных взаимодействующих химических реакций, показанных на рисунке. На первом этапе процесса диоксид углерода (CO 2 ) проходит через концентрированный водный раствор хлорида натрия (поваренная соль, NaCl) и аммиака (NH 3 ).
- ---(Я)
В промышленной практике реакцию проводят, пропуская концентрированный рассол (соленую воду) через две башни. В первом случае аммиак пузырится через рассол и поглощается им. Во втором случае диоксид углерода пузырится через аммонизированный рассол, а бикарбонат натрия (пищевая сода) выпадает в осадок из раствора. Обратите внимание, что в щелочном растворе NaHCO 3 менее растворим в воде, чем хлорид натрия. Аммиак (NH 3 ) буферизует раствор при щелочном (высоком) pH ; без аммиака побочный продукт соляной кислоты сделает раствор кислым и остановит осаждение. Здесь NH 4 вместе с аммиачным рассолом действует как «маточный раствор».
Необходимый аммиачный «катализатор» для реакции (I) регенерируется на более поздней стадии, и расходуется относительно мало аммиака. Диоксид углерода, необходимый для реакции (I), получают нагреванием (« прокаливанием ») известняка при 950–1100 ° C и прокаливанием бикарбоната натрия (см. Ниже). Карбонат кальция (CaCO 3 ) в известняке частично превращается в негашеную известь (оксид кальция (CaO)) и диоксид углерода:
- --- (II)
Бикарбонат натрия (NaHCO 3 ), который выпадает в осадок в реакции (I), отфильтровывается из горячего раствора хлорида аммония (NH 4 Cl), и раствор затем реагирует с негашеной известью (оксид кальция (CaO)), оставшейся после нагревания. известняк на стадии (II).
- --- (III)
CaO представляет собой сильный основной раствор. Аммиак из реакции (III) рециркулируют обратно в исходный солевой раствор реакции (I).
Осадок бикарбоната натрия (NaHCO 3 ) из реакции (I) затем превращается в конечный продукт, карбонат натрия (промывочная сода: Na 2 CO 3 ), путем прокаливания (160–230 ° C) с образованием воды и диоксида углерода в качестве побочных продуктов. :
- --- (IV)
Диоксид углерода со стадии (IV) восстанавливается для повторного использования на стадии (I). При правильном проектировании и эксплуатации установка Solvay может регенерировать почти весь свой аммиак и потребляет лишь небольшое количество дополнительного аммиака для компенсации потерь. Единственными основными ингредиентами процесса Solvay являются соль, известняк и тепловая энергия , а единственным основным побочным продуктом является хлорид кальция , который иногда продается как дорожная соль .
В модифицированном процессе Сольвея, разработанном китайским химиком Хоу Дебангом в 1930-х годах, первые несколько шагов такие же, как и в процессе Сольвея . Однако CaCl 2 заменяется хлоридом аммония (NH 4 Cl). Вместо того, чтобы обрабатывать оставшийся раствор известью, в раствор закачивают диоксид углерода и аммиак, затем добавляют хлорид натрия до тех пор, пока раствор не насыщается при 40 ° C. Далее раствор охлаждают до 10 ° С. Хлорид аммония выпадает в осадок и удаляется фильтрацией, а раствор рециркулируется для получения большего количества карбоната натрия. Процесс Хоу исключает производство хлорида кальция. Побочный продукт хлорида аммония может быть очищен, использован в качестве удобрения и может иметь более высокую коммерческую ценность, чем CaCl 2 , тем самым уменьшая площадь скоплений отходов.
Дополнительная информация о промышленном внедрении этого процесса доступна в отчете, подготовленном для Европейской ассоциации производителей кальцинированной соды.
Побочные продукты и отходы
Основным побочным продуктом процесса Solvay является хлорид кальция (CaCl 2 ) в водном растворе. В процессе присутствуют также другие отходы и побочные продукты. Не весь кальцинированный известняк превращается в негашеную известь и диоксид углерода (в реакции II); остаточный карбонат кальция и другие компоненты известняка становятся отходами. Кроме того, солевой раствор, используемый в процессе, обычно очищается от ионов магния и кальция, обычно с образованием карбонатов; в противном случае эти примеси могут привести к образованию накипи в различных реакционных сосудах и башнях. Эти карбонаты являются дополнительными отходами.
На заводах, расположенных внутри страны, например, в Солвей, штат Нью-Йорк , побочные продукты сбрасываются в «мусорные ямы»; вес материала, осажденного на этих свалках, превышал вес произведенной кальцинированной соды примерно на 50%. Эти отстойники привели к загрязнению воды, в основном кальцием и хлоридом. Пустоши в Солвей, штат Нью-Йорк, значительно увеличили соленость в близлежащем озере Онондага , которое раньше было одним из самых загрязненных озер в США и является местом загрязнения сверхфонда . По мере того, как такие пустоши стареют, они начинают поддерживать растительные сообщества, которые были предметом нескольких научных исследований.
В приморских районах, таких как Саураштра , Гуджарат, Индия, раствор CaCl 2 может быть сброшен прямо в море, очевидно, без существенного вреда для окружающей среды, основная проблема заключается в том, что место сброса находится в пределах морского национального парка в заливе Кач, который обслуживает как среда обитания коралловых рифов, водорослей и водорослей. В Осборне, Южная Австралия , в настоящее время используется отстойник для удаления 99% CaCl 2, поскольку предыдущие выбросы заиливали судоходный канал. В Rosignano Solvay в Тоскане, Италия, известняковые отходы, произведенные на фабрике Solvay, изменили ландшафт, создав «Spiagge Bianche» («Белые пляжи»). В отчете, опубликованном в 1999 году Программой Организации Объединенных Наций по окружающей среде (ЮНЕП), Spiagge Bianche назван в числе приоритетных очагов загрязнения в прибрежных районах Средиземного моря.
Связывание углерода и процесс Сольвея
Для связывания углерода были предложены варианты процесса Сольвея . Одна из идей состоит в том, чтобы вступить в реакцию с углекислым газом, образующимся, возможно, при сгорании угля, с образованием твердых карбонатов (таких как бикарбонат натрия), которые можно было бы хранить постоянно, что позволяет избежать выброса углекислого газа в атмосферу. Процесс Сольвея можно модифицировать, чтобы получить общую реакцию:
- 2 NaCl + CaCO 3 + CO
2+ H
2О → 2NaHCO 3 + CaCl 2
Для преобразования выбросов углекислого газа в карбонаты натрия были предложены варианты процесса Solvay, но связывание углерода карбонатами кальция или магния представляется более перспективным. Однако количество углекислого газа, истощенного человечеством, по сравнению с количеством, которое может быть использовано для связывания углерода с кальцием или магнием, очень мало. Более того, изменение процесса Solvay, скорее всего, добавит дополнительную энергетическую ступень, что увеличит выбросы углекислого газа.
Смотрите также
использованная литература
дальнейшее чтение
- Моффат, Вики; Уолмсли, MRW (2006). «Понимание кинетики прокаливания извести для снижения затрат на энергию» . Техническая ассоциация целлюлозно-бумажной промышленности Южной Африки. Минимальная энергия, необходимая для обжига известняка, составляет около 3,16 гигаджоулей (3,00 миллиона британских термических единиц) на тонну.