Легочный альвеолярный протеиноз - Pulmonary alveolar proteinosis
| Легочный альвеолярный протеиноз | |
|---|---|
| Другие имена | альвеолярный протеиноз |
 | |
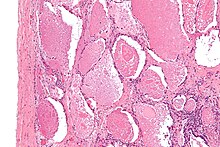
| Микрофотография легочного альвеолярного протеиноза, показывающая характерное заполнение воздушного пространства фокально плотными шариками, называемыми дребезжащими или плотными телами . Пятно H&E . | |
| Специальность |
Пульмонология |
Легочный альвеолярный протеиноз ( ЛАП ) - редкое заболевание легких, характеризующееся аномальным накоплением липопротеиновых соединений, производных сурфактанта, в альвеолах легких. Накопленные вещества мешают нормальному газообмену и расширению легких, что в конечном итоге приводит к затруднению дыхания и предрасположенности к развитию инфекций легких. Причины PAP могут быть сгруппированы на первичные (аутоиммунный PAP, наследственный PAP), вторичные (множественные заболевания) и врожденные (множественные заболевания, обычно генетические) причины, хотя наиболее частой причиной является первичное аутоиммунное состояние у человека.
Признаки и симптомы
Признаки и симптомы ПАП включают одышку , кашель , субфебрильную температуру и потерю веса . Кроме того, клиническое течение ПАП непредсказуемо. Распознается спонтанная ремиссия , и у некоторых пациентов симптомы стабильны. Смерть может наступить из-за прогрессирования ПАП или любого сопутствующего заболевания. Люди с ПАП более уязвимы к легочным инфекциям, таким как бактериальная пневмония , внутриклеточная инфекция Mycobacterium avium или грибковая инфекция .
Причины
Аномальное накопление липопротеиновых соединений в ПАП происходит из-за нарушения регуляции и клиренса сурфактанта. Обычно это связано с нарушением функции альвеолярных макрофагов. У взрослых наиболее частой причиной ПАП является аутоиммунитет к гранулоцитарно-макрофагальному колониестимулирующему фактору (GM-CSF), критическому фактору в развитии альвеолярных макрофагов. Снижение биодоступности GM-CSF приводит к плохому развитию и функции альвеолярных макрофагов, что приводит к накоплению сурфактанта и связанных с ним продуктов.
Вторичные причины ПАП - это те, при которых накопление липопротеиновых соединений является вторичным по отношению к другому болезненному процессу. Это было обнаружено в условиях некоторых видов рака (например, миелоидного лейкоза ), инфекций легких или воздействия пыли или химических веществ , таких как никель , в окружающей среде .
Хотя причина ПАП изначально не была понята, серьезным прорывом в понимании причины заболевания стало случайное наблюдение, что мышей, выведенных для экспериментального исследования, лишены гематологического фактора роста, известного как фактор, стимулирующий колонии гранулоцитов-макрофагов (GM- CSF) развился легочный синдром аномального накопления сурфактанта, напоминающий человеческий PAP.
Последствия этого открытия все еще изучаются, но в феврале 2007 года сообщалось о значительном прогрессе. В этом отчете исследователи обсуждали наличие аутоантител против GM-CSF у пациентов с ПАП и дублировали этот синдром с помощью инфузии этих аутоантител мышам. .
Семейные или спорадические инактивирующие мутации в одном из двух родительских генов GATA2 вызывают аутосомно-доминантное заболевание, называемое дефицитом GATA2 . Ген GATA2 продуцирует фактор транскрипции GATA2, который имеет решающее значение для эмбрионального развития , поддержания и функционирования кроветворных , лимфатических и других тканеобразующих клеток. Лица с единственной инактивирующей мутацией GATA2 имеют широкий спектр заболеваний, включая легочный альвеолярный протеиноз. Легочный альвеолярный протеиноз, основанный на мутации GATA2, связан с нормальным уровнем GM-CSF и обычно улучшает или его избегают у больных, которым успешно проведена трансплантация гемопоэтических стволовых клеток .
Генетика
Наследственный легочный альвеолярный протеиноз - это рецессивное генетическое заболевание, при котором люди рождаются с генетическими мутациями, которые ухудшают функцию рецептора CSF2 альфа на альвеолярных макрофагах. Следовательно, молекула-мессенджер, известная как фактор, стимулирующий колонии гранулоцитов / макрофагов (GM-CSF), не может стимулировать альвеолярные макрофаги к очистке сурфактанта, что приводит к затруднению дыхания. Ген рецептора CSF2 альфа расположен в области 5q31 хромосомы 5, и этот генный продукт также может называться рецептором колониестимулирующего фактора макрофагов гранулоцитов.
Диагностика
Диагноз ППА производится с использованием комбинации признаков человека, визуализации грудной клетки , и микроскопические оценки легких стиральной / ткани . Дополнительное тестирование на антитела к GM-CSF в сыворотке полезно для подтверждения.
Хотя как симптомы, так и результаты визуализации стереотипны и хорошо описаны, они неспецифичны и неотличимы от многих других состояний. Например, рентген грудной клетки может показать помутнение альвеол, а КТ может показать сумасшедший узор легких , оба из которых чаще наблюдаются при многих других состояниях. Таким образом, диагноз в первую очередь зависит от результатов патологии.
Смывы легких или ткани для гистопатологического анализа чаще всего получают с помощью бронхоальвеолярного лаважа и / или биопсии легких. Результаты Характерных биопсий показывают заполнение альвеол (а иногда и терминальных бронхиол) с аморфным эозинофильным материалом, который пятно сильно положительным на PAS пятне и ПАС диастазы пятне . Окружающие альвеолы и легочный интерстиций остаются относительно нормальными. Электронная микроскопия образца, хотя ее обычно не проводят из-за непрактичности, показывает пластинчатые тела, представляющие собой поверхностно-активное вещество. Альтернативный диагноз со схожими гистоморфологическими данными - пневмония, вызванная Pneumocystis jirovicii .
Смывы из легких обычно дают жидкость «молочного» состава. Под микроскопом образцы показывают PAS-положительные глобулы размером 20-50 мкм на фоне мелкозернистого или аморфного PAS-положительного материала. Обычно существует небольшое количество макрофагов и воспалительных клеток (хотя это может быть разным).
Уход
Стандартным лечением ПАП является промывание всего легкого и поддерживающая терапия. Промывание всего легкого - это процедура, выполняемая под общим наркозом, при которой одно легкое нагнетается кислородом (вентилируемое легкое), а другое легкое (невентилируемое легкое) заполняется теплым физиологическим раствором (до 20 л) и дренируется. удаление любых белковых стоков вместе с ним. Как правило, это эффективно для улучшения симптомов ПАП, часто в течение длительного периода времени. Другие методы лечения, которые все еще изучаются, включают подкожный и ингаляционный GM-CSF и ритуксимаб, внутривенное вливание, которое работает, чтобы остановить производство аутоантител, ответственных за аутоиммунную PAP. Трансплантация легких выполнялась людям с различными формами ПАП; однако это часто используется только в том случае, если все другие варианты лечения оказались безуспешными и развилось значительное повреждение легких из-за рисков, осложнений или рецидива ПАП после трансплантации.
Эпидемиология
Заболевание чаще встречается у мужчин и у курильщиков табака .
В недавнем эпидемиологическом исследовании, проведенном в Японии, аутоиммунная ПАП имеет более высокую заболеваемость и распространенность, чем сообщалось ранее, и не имеет прочной связи с курением, профессиональным воздействием или другими заболеваниями. Эндогенная липоидная пневмония и неспецифический интерстициальный пневмонит наблюдались до развития ПАП у ребенка.
История
Впервые ПАП был описан в 1958 году врачами Сэмюэлем Розеном, Бенджамином Кастлманом и Авериллом Либоу . В серии их случаев, опубликованных в Медицинском журнале Новой Англии 7 июня того же года, они описали 27 пациентов с патологическими свидетельствами наличия периодической кислоты, положительной по Шиффу, заполняющей альвеолы. Этот богатый липидами материал впоследствии был признан поверхностно-активным веществом.
Сообщалось о лечении ПАП с использованием лечебного бронхоальвеолярного лаважа в 1960 году доктором Хосе Рамирес-Ривера из Госпиталя ветеранов в Балтиморе, который описал повторяющиеся «сегментарные наводнения» как средство физического удаления накопленного альвеолярного материала.
Исследовать
ПАП - одно из редких заболеваний легких, которое в настоящее время изучается Консорциумом редких заболеваний легких. Консорциум является частью Сети клинических исследований редких заболеваний , инициативы Управления исследований редких заболеваний , Национального центра развития трансляционных наук , и посвящен разработке новых диагностических и терапевтических средств для пациентов с редкими заболеваниями легких посредством сотрудничества между Национальные институты здравоохранения , организации пациентов и клинические исследователи.
использованная литература
внешние ссылки
| Классификация | |
|---|---|
| Внешние ресурсы |