Фосфатидная кислота - Phosphatidic acid
Фосфатидные кислоты представляют собой анионные фосфолипиды, важные для передачи клеточных сигналов и прямой активации липидно-зависимых ионных каналов . Гидролиз фосфатидной кислоты дает по одной молекуле глицерина и фосфорной кислоты и по две молекулы жирных кислот. Они составляют около 0,25% фосфолипидов в бислое.
Состав
Фосфатидная кислота состоит из глицериновой основной цепи, в основном из насыщенной жирной кислоты, связанной с углеродом -1, ненасыщенной жирной кислоты, связанной с углеродом -2, и фосфатной группы, связанной с углеродом -3.
Формирование и деградация
Помимо синтеза de novo, PA может быть образован тремя способами:
- По фосфолипазы D (PLD), через гидролиз PO облигации фосфатидилхолина (PC) , чтобы произвести PA и холин .
- За счет фосфорилирования диацилглицерина (ДАГ) киназой ДАГ (ДАГК)
- Путем ацилирования лизофосфатидной кислоты лизоПА-ацилтрансферазой (LPAAT); это наиболее распространенный путь .
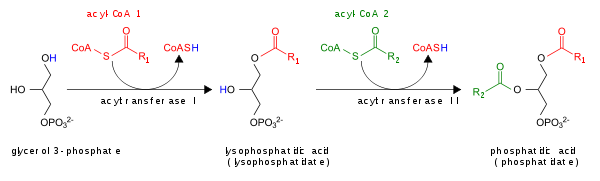
ПА ухудшается превращением в DAG с липидными фосфатных phosphohydrolases (LPPS) или в лизо-PA с помощью фосфолипазы A (PLA).
Роли в ячейке
Роль ПА в клетке можно разделить на три категории:
- PA является предшественником биосинтеза многих других липидов.
- Физические свойства ПА влияют на кривизну мембраны.
- PA действует как сигнальный липид, рекрутируя цитозольные белки на соответствующие мембраны (например, сфингозинкиназу 1 ).
- PA играет очень важную роль в фототрансдукции у Drosophila.
- PA представляет собой липидный лиганд, который закрывает ионные каналы. См. Также ионные каналы, управляемые липидами .
Первые три роли не исключают друг друга. Например, PA может участвовать в образовании пузырьков, способствуя кривизне мембраны и рекрутируя белки для выполнения гораздо более энергетически невыгодной задачи образования шейки и защемления.
Роли в биосинтезе
PA - это жизненно важный клеточный липид, который действует как биосинтетический предшественник для образования (прямо или косвенно) всех липидов ацилглицерина в клетке.
В клетках млекопитающих и дрожжевых клетках известны два разных пути синтеза PA de novo: глицерин-3-фосфатный путь или дигидроксиацетонфосфатный путь. У бактерий присутствует только первый путь, и мутации, блокирующие этот путь, являются летальными, что демонстрирует важность PA. В клетках млекопитающих и дрожжей, где ферменты в этих путях избыточны, мутация любого фермента не является летальной. Однако стоит отметить, что in vitro различные ацилтрансферазы проявляют различную субстратную специфичность в отношении ацил-КоА, которые включены в PA. Различные ацилтрансферазы также имеют различное внутриклеточное распределение, такое как эндоплазматический ретикулум (ER), митохондрии или пероксисомы, и локальные концентрации активированных жирных кислот. Это предполагает, что различные ацилтрансферазы, присутствующие в клетках млекопитающих и дрожжей, могут быть ответственны за продукцию разных пулов PA.
Превращение PA в диацилглицерин (DAG) с помощью LPP является обязательным этапом для производства фосфатидилхолина (PC), фосфатидилэтаноламина (PE) и фосфатидилсерина (PS). Кроме того, DAG также превращается в CDP-DAG, который является предшественником фосфатидилглицерина (PG), фосфатидилинозитола (PI) и фосфоинозитидов (PIP, PIP 2 , PIP 3 ).
Концентрации PA поддерживаются на чрезвычайно низком уровне в клетке за счет активности сильнодействующих LPP. Они очень быстро превращают PA в DAG, и, поскольку DAG является предшественником многих других липидов, он также вскоре метаболизируется в другие мембранные липиды. Это означает, что любая повышающая регуляция продукции PA может быть согласована со временем с соответствующей повышающей регуляцией LPP и ферментов, метаболизирующих DAG.
Следовательно, PA необходим для синтеза липидов и выживания клеток, но в нормальных условиях поддерживается на очень низком уровне в клетке.
Биофизические свойства
PA является уникальным фосфолипидом тем, что он имеет небольшую высоко заряженную головную группу, которая очень близка к основной цепи глицерина. Известно, что PA играет роль как в делении, так и в слиянии пузырьков , и эти роли могут иметь отношение к биофизическим свойствам PA.
В местах отрастания или слияния мембраны мембрана становится или сильно изогнута. Важным событием в отрастании пузырьков, таких как переносчики из Гольджи , является создание и последующее сужение шейки мембраны. Исследования показали, что этот процесс может быть вызван липидами, и постулировали центральную роль DAG из-за его уникальной молекулярной формы. Наличие двух ацильных цепей, но без головной группы приводит к большой отрицательной кривизне мембран.
LPAAT BARS-50 также участвовал в почковании от Golgi. Это говорит о том, что превращение лизоПА в РА может влиять на кривизну мембраны. Активность LPAAT удваивает количество ацильных цепей, значительно увеличивая площадь поперечного сечения липида, который находится «внутри» мембраны, в то время как поверхностная головная группа остается неизменной. Это может привести к более отрицательной кривизне мембраны. Исследователи из Утрехтского университета изучили влияние лизоПА по сравнению с ПА на кривизну мембраны, измерив их влияние на температуру перехода ПЭ от липидных бислоев к неламеллярным фазам с помощью 31 P-ЯМР. Было показано, что искривление, индуцированное этими липидами, зависит не только от структуры лизоПА по сравнению с PA, но также от динамических свойств, таких как гидратация головных групп и меж- и внутримолекулярные взаимодействия. Например, Ca 2+ может взаимодействовать с двумя PA с образованием нейтрального, но сильно изогнутого комплекса. Нейтрализация в противном случае отталкивающих зарядов головных групп и отсутствие каких-либо стерических препятствий делает возможными сильные межмолекулярные взаимодействия между ацильными цепями, что приводит к образованию микродоменов, богатых ПА. Таким образом, in vitro физиологические изменения pH, температуры и концентрации катионов оказывают сильное влияние на кривизну мембраны, вызванную PA и lysoPA. Взаимопревращение лизоПА, PA и DAG - а также изменения pH и концентрации катионов - могут вызывать изгиб и дестабилизацию мембраны, играя прямую роль в делении мембраны просто в силу своих биофизических свойств. Однако, хотя было показано, что PA и lysoPA влияют на кривизну мембраны in vitro ; их роль in vivo неясна.
Роль lysoPA, PA и DAG в обеспечении кривизны мембраны не исключает их роли в рекрутировании белков на мембрану. Например, потребность в Ca 2+ для слияния сложных липосом не сильно зависит от добавления аннексина I, хотя она снижается за счет PLD. Однако с аннексином I и PLD степень слияния значительно увеличивается, а потребность в Ca 2+ снижается почти в 1000 раз до почти физиологических уровней.
Таким образом, метаболические, биофизические, рекрутинговые и сигнальные роли PA могут быть взаимосвязаны.
Роль в сигнализации
PA удерживается на низком уровне в объеме мембраны, чтобы временно взорваться и локально передать сигнал в высокой концентрации. Например, каналы TREK-1 активируются локальной ассоциацией с PLD и производством PA. Константа диссоциации ПА для ТРЕК-1 составляет примерно 10 мкмоль. Относительно слабое связывание в сочетании с низкой концентрацией PA в мембране позволяет каналу отключаться. Высокая локальная концентрация для активации предполагает, по крайней мере, некоторые ограничения в локальной диффузии липидов. Основная низкая концентрация PA в сочетании с высокими локальными всплесками противоположна передаче сигналов PIP2. PIP2 удерживается на относительно высоком уровне в мембране и затем временно гидролизуется рядом с белком, чтобы временно снизить передачу сигналов PIP2. Передача сигналов PA отражает передачу сигналов PIP2 в том смысле, что основная концентрация сигнального липида не должна изменяться для оказания мощного местного эффекта на целевой белок.
Как описано выше, PLD гидролизует PC с образованием PA и холина . Поскольку холина очень много в клетке, активность PLD существенно не влияет на уровень холина; и холин вряд ли играет какую-либо роль в передаче сигналов.
Роль активации PLD во многих контекстах передачи сигналов, в сочетании с отсутствием роли холина, предполагает, что PA играет важную роль в передаче сигналов. Однако PA быстро превращается в DAG, и DAG также известен как сигнальная молекула. Это поднимает вопрос, играет ли PA какую-либо прямую роль в передаче сигналов или он просто действует как предшественник для продукции DAG. Если будет обнаружено, что PA действует только как предшественник DAG, тогда можно поднять вопрос о том, почему клетки должны производить DAG с использованием двух ферментов, если они содержат PLC, который может продуцировать DAG за одну стадию.
PA, продуцируемый PLD или DAGK, можно отличить по добавлению [γ- 32 P] ATP. Это покажет, является ли фосфатная группа новым производным от киназной активности или происходит от ПК.
Хотя PA и DAG взаимопревращаемы, они действуют по-разному. Стимулы, активирующие PLD, не активируют ферменты, расположенные ниже DAG, и наоборот. Например, было показано, что добавление PLD к мембранам приводит к образованию [ 32 P]-меченых РА и [ 32 P]-меченных фосфоинозитидов. Добавление ингибиторов DAGK устраняет продукцию [ 32 P]-меченого PA, но не стимулирует PLD-стимулированное производство фосфоинозитидов.
Возможно, что, хотя PA и DAG являются взаимопревращаемыми, отдельные пулы сигнальных и несигнальных липидов могут сохраняться. Исследования показали, что передача сигналов DAG опосредуется полиненасыщенным DAG, тогда как PA, происходящий из PLD, является мононенасыщенным или насыщенным. Таким образом, функциональный насыщенный / мононенасыщенный PA может быть разложен путем его гидролиза с образованием нефункционального насыщенного / мононенасыщенного DAG, тогда как функциональный полиненасыщенный DAG может быть разложен путем преобразования его в нефункциональный полиненасыщенный PA.
Эта модель предполагает, что эффекторы PA и DAG должны быть способны различать липиды с одинаковыми головными группами, но с разными ацильными цепями. Хотя некоторые липид-связывающие белки способны встраиваться в мембраны и гипотетически распознавать тип ацильной цепи или результирующие свойства мембраны, многие липид-связывающие белки являются цитозольными и локализуются на мембране, связывая только головные группы липидов. Возможно, различные ацильные цепи могут влиять на угол наклона головной группы в мембране. Если это так, это предполагает, что PA-связывающий домен должен быть не только способен специфически связывать PA, но также должен быть способен идентифицировать те головные группы, которые находятся под правильным углом. Каким бы ни был механизм, такая специфика возможна. Это наблюдается в DAGK семенников свиней, который специфичен для полиненасыщенного DAG, и в двух LPP гепатоцитов крысы, которые дефосфорилируют различные виды PA с различной активностью. Более того, было показано , что стимуляция активности SK1 с помощью PS in vitro сильно варьируется в зависимости от того, использовались ли диолеоил (C18: 1), дистеароил (C18: 0) или 1-стеароил, 2-олеоил разновидности PS. Таким образом, кажется, что, хотя PA и DAG взаимопревращаемы, разные виды липидов могут иметь разную биологическую активность; и это может позволить двум липидам поддерживать отдельные сигнальные пути.
Измерение производства PA
Поскольку PA быстро превращается в DAG, он очень недолговечен в клетке. Это означает, что сложно измерить продукцию PA и, следовательно, изучить роль PA в клетке. Однако активность PLD можно измерить путем добавления в ячейку первичных спиртов. Затем PLD проводит реакцию трансфосфатидилирования вместо гидролиза с образованием фосфатидиловых спиртов вместо PA. Фосфатидиловые спирты являются тупиками метаболизма, и их можно легко извлечь и измерить. Таким образом, можно измерить активность PLD и продукцию PA (если не сам PA), и, блокируя образование PA, можно сделать вывод об участии PA в клеточных процессах.

