Молярная теплоемкость - Molar heat capacity
Молярная теплоемкость из химического вещества представляет собой количество энергии , которое должно быть добавлено в виде тепла , на один моль вещества для того , чтобы вызвать увеличение на одну единицу в ее температуры . В качестве альтернативы, это теплоемкость образца вещества, деленная на количество вещества в образце; или также удельная теплоемкость вещества, умноженная на его молярную массу . СИ единица теплоемкости джоуль на кельвин на моль, J⋅K -1 ⋅mol -1 .
Как и удельная теплоемкость, измеренная молярная теплоемкость вещества, особенно газа, может быть значительно выше, когда образец расширяется при нагревании ( при постоянном давлении или изобарическом ), чем при нагревании в закрытом сосуде, который предотвращает расширение ( при постоянном объеме или изохорном ). Однако соотношение между ними является таким же соотношением теплоемкостей, полученным из соответствующих удельных теплоемкостей.
Это свойство наиболее актуально в химии , где количество веществ часто указывается в молях, а не по массе или объему. Молярная теплоемкость обычно увеличивается с увеличением молярной массы, часто изменяется с температурой и давлением и различается для каждого состояния вещества . Например, при атмосферном давлении (изобарическая) молярная теплоемкость воды чуть выше точки плавления составляет примерно 76 Дж⋅К -1 моль -1 , а у льда чуть ниже этой точки - примерно 37,84 Дж⋅К -1. ⋅mol −1 . Пока вещество претерпевает фазовый переход , такой как плавление или кипение, его молярная теплоемкость технически бесконечна , потому что тепло переходит в изменение своего состояния, а не на повышение его температуры. Эта концепция не подходит для веществ, точный состав которых неизвестен или чья молярная масса не определена четко, например, полимеры и олигомеры с неопределенным молекулярным размером.
Тесно связанным свойством вещества является теплоемкость на моль атомов или атомно-молярная теплоемкость , при которой теплоемкость образца делится на количество молей атомов, а не молей молекул. Так, например, атомно-молярная теплоемкость воды составляет 1/3 ее молярной теплоемкости, а именно 25,3 Дж⋅К -1 моль -1 .
В контексте неформальной химии молярная теплоемкость может называться просто «теплоемкостью» или «удельной теплоемкостью». Однако международные стандарты теперь рекомендуют, чтобы «удельная теплоемкость» всегда относилась к мощности на единицу массы, чтобы избежать возможной путаницы. Следовательно, для этого количества всегда следует использовать слово «молярный», а не «конкретный».
Определение
Молярная теплоемкость вещества, которую можно обозначить как c m , - это теплоемкость C образца вещества, деленная на количество (моль) n вещества в образце:
- с м
где ΔQ - количество тепла, необходимое для повышения температуры образца на ΔT . Очевидно, что этот параметр не может быть вычислен, если n неизвестно или не определено.
Как и теплоемкость объекта, молярная теплоемкость вещества может варьироваться, иногда существенно, в зависимости от начальной температуры T образца и приложенного к нему давления P. Следовательно, его следует рассматривать как функцию c m ( P , T ) этих двух переменных.
Эти параметры обычно указываются при указании молярной теплоемкости вещества. Например, «H 2 O: 75,338 Дж · К -1 · моль -1 (25 ° C, 101,325 кПа)» Если не указано иное, опубликованные значения молярной теплоемкости c m обычно действительны для некоторых стандартных условий для температуры и давление .
Однако зависимость c m ( P , T ) от начальной температуры и давления часто можно игнорировать на практике, например, при работе в узких диапазонах этих переменных. В этих контекстах обычно можно опустить квалификатор ( P , T ) и аппроксимировать молярную теплоемкость константой c m, подходящей для этих диапазонов.
Поскольку молярная теплоемкость вещества представляет собой удельную теплоемкость c, умноженную на молярную массу вещества M / N, ее численное значение обычно меньше, чем удельная теплоемкость. Например, парафиновый воск имеет удельную теплоемкость около2500 Дж⋅K −1 ⋅kg −1, но молярная теплоемкость около600 Дж⋅К −1 мкмоль −1 .
Молярная теплоемкость - это «интенсивное» свойство вещества, внутренняя характеристика, которая не зависит от размера или формы рассматриваемого количества. (Квалификатор «специфический» перед экстенсивным свойством часто указывает на интенсивное свойство, производное от него.)
Вариации
Введение тепловой энергии в вещество, помимо повышения его температуры, обычно вызывает увеличение его объема и / или его давления, в зависимости от того, как удерживается образец. Выбор , сделанный о последнем влияет на измеренную молярную теплоемкость, даже для одной и того же начального давления Р и начальная температура T . Широко используются два конкретных варианта:
- Если давление поддерживается постоянным (например, при атмосферном давлении окружающей среды) и образец расширяется, расширение создает работу, поскольку сила давления смещает корпус. Эта работа должна производиться за счет выделяемой тепловой энергии. Полученное таким образом значение называется молярной теплоемкостью при постоянном давлении (или изобарическом ) и часто обозначается как c P , m , c p , m , c P, m и т. Д.
- С другой стороны, если расширение предотвращается - например, с помощью достаточно жесткого корпуса или путем увеличения внешнего давления, чтобы противодействовать внутреннему, - работа не создается, и тепловая энергия, которая пошла бы в него, должна вместо этого способствовать внутренняя энергия объекта, включая повышение его температуры на дополнительную величину. Полученное таким образом значение называется молярной теплоемкостью при постоянном объеме (или изохорной ) и обозначается c V , m , c v , m , c v, m и т. Д.
Значение c V , m обычно меньше, чем значение c P , m . Эта разница особенно заметна для газов, где значения при постоянном давлении обычно на 30–66,7% больше, чем при постоянном объеме.
Все методы измерения удельной теплоемкости применимы также к молярной теплоемкости.
Единицы
Единица измерения молярной теплоемкости в системе СИ - джоуль на кельвин на моль (Дж / (К · моль), Дж / (К · моль), Дж · К − 1 · моль −1 и т. Д.). Поскольку приращение температуры на один градус Цельсия совпадает с приращением одного градуса Цельсия, это то же самое, что и джоуль на градус Цельсия на моль (Дж / (° C · моль)).
В химии количество тепла все еще часто измеряется в калориях . Как ни странно, две единицы с таким названием, обозначаемые «cal» или «Cal», обычно использовались для измерения количества тепла:
- «малая калорийность» (или «грамм-калория», «кал») точно равна 4,184 Дж.
- «Большая калория» (также «килокалория», «килограмм-калория» или «пищевая калория»; «ккал» или «кал») составляет 1000 малых калорий, то есть ровно 4184 Дж.
Когда тепло измеряется в этих единицах, единицей удельной теплоемкости обычно является
- 1 кал / (° C⋅моль) («малая калория») = 4,184 Дж⋅K −1 mol −1
- 1 ккал / (° C⋅моль) («большая калорийность») = 4184 Дж⋅K −1 mol −1 .
Молярная теплоемкость вещества имеет тот же размер, что и теплоемкость объекта; а именно, L 2 ⋅M⋅T −2 ⋅Θ −1 или M (L / T) 2 / Θ. (На самом деле, это теплоемкость объекта, которая состоит из числа молекул вещества Авогадро.) Следовательно, единица СИ Дж⋅K −1 mol −1 эквивалентна килограмм-метру в квадрате в секунду в квадрате на кельвин ( кг⋅м 2 ⋅K −1 ⋅s −2 ).
Физические основы молярной теплоемкости
Молярная теплоемкость одноатомных газов
Температура образца вещества отражает среднюю кинетическую энергию составляющих его частиц (атомов или молекул) относительно его центра масс. Квантовая механика предсказывает, что при комнатной температуре и обычном давлении изолированный атом в газе не может хранить сколько-нибудь значимое количество энергии, кроме как в виде кинетической энергии. Следовательно, когда определенное количество N атомов одноатомного газа получает ввод Δ Q тепловой энергии в контейнере фиксированного объема, кинетическая энергия каждого атома увеличивается на Δ Q / N , независимо от массы атома. Это предположение лежит в основе теории идеальных газов .
Другими словами, эта теория предсказывает, что молярная теплоемкость при постоянном объеме c V , m всех одноатомных газов будет одинаковой; конкретно,
- c V , m = 3/2р
где R - постоянная идеального газа , около 8,31446 Дж · К −1 · моль −1 (которая является произведением постоянной Больцмана k B и числа Авогадро ). И действительно, экспериментальные значения c V , m для благородных газов гелия , неона , аргона , криптона и ксенона (при 1 атм и 25 ° C) все равны 12,5 Дж⋅K −1 mol −1 , что составляет3/2R ; хотя их атомный вес колеблется от 4 до 131.
Та же теория предсказывает, что молярная теплоемкость одноатомного газа при постоянном давлении будет
- c P , m = c V , m + R =5/2р
Это предсказание соответствует экспериментальным значениям, которые для гелия через ксенон составляют 20,78, 20,79, 20,85, 20,95 и 21,01 Дж⋅K −1 mol −1 соответственно; очень близко к теоретическому5/2R = 20,78 Дж⋅К −1 мкмоль −1 .
Таким образом, удельная теплоемкость (на единицу массы, а не на моль) одноатомного газа будет обратно пропорциональна его (adimensional) атомным весом А . То есть примерно
- c V = (12470 Дж⋅K −1 kg −1 ) / A c P = (20786 Дж⋅K −1 kg −1 ) / A
Молярная теплоемкость многоатомных газов
Степени свободы
Многоатомная молекула (состоящая из двух или более связанных вместе атомов) может накапливать тепловую энергию в других формах, помимо своей кинетической энергии. Эти формы включают вращение молекулы и колебание атомов относительно ее центра масс.
Эти дополнительные степени свободы влияют на молярную теплоемкость вещества. А именно, когда в газ с многоатомными молекулами вводится тепловая энергия, только часть ее идет на увеличение их кинетической энергии и, следовательно, температуры; остальное перейдет в те другие степени свободы. Таким образом, для достижения такого же повышения температуры моль этого вещества должен быть обеспечен большей тепловой энергией, чем моль одноатомного газа. Вещества с высоким атомным числом на молекулу, такие как октан , могут поэтому иметь очень большую теплоемкость на моль, но при этом относительно небольшую удельную теплоемкость (на единицу массы).
Если бы молекулу можно было полностью описать с помощью классической механики, то теорему о равнораспределении энергии можно было бы использовать для предсказания того, что каждая степень свободы будет иметь среднюю энергию в размере1/2kT , где k - постоянная Больцмана, а T - температура. Если число степеней свободы молекулы равно f , то каждая молекула будет обладать в среднем полной энергией, равной1/2fkT . Тогда молярная теплоемкость (при постоянном объеме) будет
- c V , m =1/2fR
где R - постоянная идеального газа. Согласно соотношению Майера , молярная теплоемкость при постоянном давлении будет
- c P , m = c V , m + R =1/2fR + R =1/2(ж + 2) R
Таким образом, каждая дополнительная степень свободы будет способствовать 1/2R к молярной теплоемкости газа (как c V , m, так и c P , m ).
В частности, каждая молекула одноатомного газа имеет только f = 3 степени свободы, а именно компоненты ее вектора скорости; поэтому c V , m =3/2R и c P , m =5/2R .
Вращательные моды двухатомной молекулы
Например, мольная теплоемкость азота N
2при постоянном объеме 20,6 J⋅K -1 ⋅mol -1 (при 15 ° C, 1 атм), который является 2.49 R . Из теоретического уравнения c V , m =1/2fR , можно сделать вывод, что каждая молекула имеет f = 5 степеней свободы. Оказывается, это три градуса вектора скорости молекулы плюс два градуса ее вращения вокруг оси, проходящей через центр масс и перпендикулярной линии двух атомов. Степени свободы, обусловленные перемещениями и вращениями, называются жесткими степенями свободы, поскольку они не связаны с какой-либо деформацией молекулы.
Из - за этих двух дополнительных степеней свободы, молярной теплоемкости гр V , м из N
2(20,6 Дж⋅K −1 mol −1 ) больше, чем у гипотетического одноатомного газа (12,5 J⋅K −1 mol −1 ) в раз5/3.
Замороженные и активные степени свободы
Согласно классической механике, двухатомная молекула, такая как азот, должна иметь больше степеней внутренней свободы, соответствующих колебаниям двух атомов, которые растягивают и сжимают связь между ними.
Для термодинамических целей каждое направление, в котором атом может независимо колебаться относительно остальной части молекулы, вводит две степени свободы: одна связана с потенциальной энергией от искажения связей, а другая - с кинетической энергией движения атома. В двухатомной молекуле, подобной N
2, существует только одно направление для вибрации, и движения двух атомов должны быть противоположными, но равными; Итак, есть только две степени вибрационной свободы. Это было бы принести F до 7, и с V , м до 3,5 R .
Причина, по которой эти колебания не поглощают ожидаемую часть подводимой тепловой энергии, обеспечивается квантовой механикой . Согласно этой теории, энергия, запасенная в каждой степени свободы, должна увеличиваться или уменьшаться только в определенных количествах (квантах). Следовательно, если температура T системы недостаточно высока, средняя энергия, доступная для некоторых теоретических степеней свободы ( kT / f ), может быть меньше соответствующего минимального кванта. Если температура достаточно низкая, это может иметь место практически для всех молекул. Затем говорят, что эти степени свободы «заморожены». Тогда молярная теплоемкость газа будет определяться только «активными» степенями свободы - которые для большинства молекул могут получать достаточно энергии, чтобы преодолеть этот квантовый порог.
Для каждой степени свободы существует приблизительная критическая температура, при которой он «тает» («размораживается») и становится активным, таким образом способным удерживать тепловую энергию. Для трех поступательных степеней свободы молекул в газе эта критическая температура чрезвычайно мала, поэтому их можно считать всегда активными. Для вращательных степеней свободы температура оттаивания обычно составляет несколько десятков кельвинов (хотя для очень легкой молекулы, такой как водород, уровни вращательной энергии будут разнесены так широко, что вращательная теплоемкость не может полностью «разморозиться» до значительно более высоких температур. достигнуты). Режимы вибрации двухатомных молекул обычно начинают активироваться только при температуре значительно выше комнатной.
В случае азота вращательные степени свободы полностью активны уже при -173 ° C (100 K, всего на 23 K выше точки кипения). С другой стороны, режимы колебаний начинают проявляться только при температуре около 350 K (77 ° C). Соответственно, молярная теплоемкость c P , m почти постоянна при 29,1 Дж⋅K −1 mol −1 от 100 K до примерно 300 ° С. Примерно при этой температуре он начинает быстро увеличиваться, затем снова замедляется. Оно составляет 35,5 Дж⋅К -1 мкмоль -1 при 1500 ° C, 36,9 при 2500 ° C и 37,5 при 3500 ° C. Последнее значение почти точно соответствует прогнозируемому значению для f = 7.

Ниже приводится таблица некоторых молярных теплоемкостей c P , m при постоянном давлении различных двухатомных газов при стандартной температуре (25 ° C = 298 K), при 500 ° C и 5000 ° C, а также кажущемся количестве градусов. свободы f * оценивается по формуле f * = 2 c P , m / R - 2:
| 25 ° C | 500 ° С | 5000 ° С | |||||
|---|---|---|---|---|---|---|---|
| Газ |
c P , м Дж⋅K −1 mol −1 |
е * |
c P , м Дж⋅K −1 mol −1 |
е * |
c P , м Дж⋅K −1 mol −1 |
е * |
|
| H 2 | 28,9 | 5.0 | 29,6 | 5.1 | 41,2 | 7.9 | Не насыщенный. |
| CO | 29,1 | 5.0 | 31,7 | 5,6 | 38,1 | 7.2 | Насыщенный. |
| № 2 | 29,1 | 5.0 | 31,3 | 5.5 | 38,0 | 7.1 | Насыщенный. |
| Cl 2 | 34,0 | 6.2 | 37,0 | 6.9 | 39,6 | 7,5 | Макс 41,3 при ~ 3700 C. |
| Br 2 (пар) | (*) 36,4 | 6,8 | 37,5 | 7.0 | 39,2 | 7,4 | Макс 41,6 при ~ 3000 C. |
(*) При 59 C (точка кипения)
Приближение квантового гармонического осциллятора подразумевает, что расстояние между уровнями энергии колебательных мод обратно пропорционально квадратному корню из приведенной массы атомов, составляющих двухатомную молекулу. Этот факт объясняет, почему колебательные моды более тяжелых молекул, таких как Br
2активны при более низких температурах. Молярная теплоемкость Br
2при комнатной температуре соответствует f = 7 степеней свободы, максимуму для двухатомной молекулы. При достаточно высоких температурах все двухатомные газы приближаются к этому значению.
Вращательные моды одиночных атомов
Квантовая механика также объясняет, почему теплоемкость одноатомных газов хорошо предсказывается теорией идеального газа с предположением, что каждая молекула является точечной массой, которая имеет только f = 3 поступательные степени свободы.
Согласно классической механике, поскольку атомы имеют ненулевой размер, они также должны иметь три степени свободы вращения, или всего f = 6. Точно так же молекула двухатомного азота должна иметь дополнительную моду вращения, а именно вокруг линии двух атомов; и, следовательно, f = 6. С классической точки зрения, каждый из этих режимов должен сохранять равную долю тепловой энергии.
Однако, согласно квантовой механике, разность энергий между разрешенными (квантованными) состояниями вращения обратно пропорциональна моменту инерции относительно соответствующей оси вращения. Поскольку момент инерции одиночного атома чрезвычайно мал, температура активации его вращательных мод чрезвычайно высока. То же самое относится к моменту инерции двухатомной молекулы (или линейной многоатомной молекулы) относительно межъядерной оси, поэтому этот режим вращения в целом неактивен.
С другой стороны, электроны и ядра могут существовать в возбужденных состояниях, и в некоторых исключительных случаях они могут быть активными даже при комнатной температуре или даже при криогенных температурах.
Многоатомные газы
Набор всех возможных способов бесконечно малого смещения n атомов многоатомной молекулы газа представляет собой линейное пространство размерностью 3 n , потому что каждый атом может быть независимо смещен в каждом из трех направлений ортогональных осей. Однако некоторые три из этих измерений представляют собой просто перенос молекулы на бесконечно малый вектор смещения, а другие - просто жесткие ее вращения на бесконечно малый угол вокруг некоторой оси. Третьи могут соответствовать относительному вращению двух частей молекулы вокруг одинарной связи, которая их соединяет.
Независимые режимы деформации - линейно независимые способы фактической деформации молекулы, которые деформируют ее связи - являются лишь оставшимися измерениями этого пространства. Как и в случае двухатомных молекул, каждая из этих мод деформации считается двумя колебательными степенями свободы для целей хранения энергии: одна для потенциальной энергии, хранящейся в напряженных связях, и одна для дополнительной кинетической энергии атомов, когда они колеблются вокруг остальная конфигурация молекулы.
В частности, если молекула линейна (со всеми атомами на прямой), у нее есть только два нетривиальных режима вращения, поскольку вращение вокруг собственной оси не смещает ни один атом. Следовательно, он имеет 3 n - 5 реальных форм деформации. Количество степеней свободы, запасающих энергию, тогда f = 3 + 2 + 2 (3 n - 5) = 6 n - 5.
Например, линейная молекула закиси азота N≡N = O (при n = 3) имеет 3 n - 5 = 4 независимых бесконечно малых режима деформации. Два из них можно описать как растягивание одной из связей, в то время как другая сохраняет свою нормальную длину. Два других можно идентифицировать, молекула изгибается у центрального атома в двух направлениях, ортогональных его оси. В каждом режиме следует предполагать, что атомы смещаются так, что центр масс остается неподвижным и вращения нет. Таким образом, молекула имеет f = 6 n - 5 = 13 полных энергозатратных степеней свободы (3 поступательных, 2 вращательных, 8 колебательных). Тогда при достаточно высокой температуре его молярная теплоемкость должна быть c P , m = 7,5 R = 62,63 Дж⋅K −1 mol −1 . Для цианогена N≡C − C≡N и ацетилена H − C≡C − H ( n = 4) тот же анализ дает f = 19 и предсказывает c P , m = 10,5 R = 87,3 Дж⋅K −1 мкмоль −1. .
Молекула с n атомами, которая является жесткой и нелинейной, имеет 3 режима трансляции и 3 нетривиальных режима вращения, следовательно, только 3 n - 6 мод деформации. Следовательно, он имеет f = 3 + 3 + 2 (3 n - 6) = 6 n - 6 энергопоглощающих степеней свободы (на одну меньше, чем у линейной молекулы с таким же количеством атомов). Вода H
2O ( n = 3) изогнут в ненатянутом состоянии, поэтому прогнозируется, что он имеет f = 12 степеней свободы. Метан CH
4( n = 5) является трехмерным, и формула предсказывает f = 24.
Этан H
3C − CH
3( n = 8) имеет 4 степени свободы вращения: две относительно осей, перпендикулярных центральной связи, и еще две, потому что каждая метильная группа может вращаться независимо от этой связи с незначительным сопротивлением. Следовательно, количество независимых мод деформации равно 3 n - 7, что дает f = 3 + 4 + 2 (3 n - 7) = 6n - 7 = 41.
В следующей таблице показаны экспериментальные молярные теплоемкости при постоянном давлении c P , m вышеупомянутых многоатомных газов при стандартной температуре (25 ° C = 298 K), при 500 ° C и 5000 ° C, а также кажущемся количестве градусов. свободы f * оценивается по формуле f * = 2 c P , m / R - 2:
| 25 ° C | 500 ° С | 5000 ° С | ||||||
|---|---|---|---|---|---|---|---|---|
| Газ |
c P , м Дж⋅K −1 mol −1 |
е * |
c P , м Дж⋅K −1 mol −1 |
е * |
c P , м Дж⋅K −1 mol −1 |
е * |
ж |
Примечания |
| N≡N = O | 38,6 | 7.3 | 51,8 | 10,5 | 62,0 | 12,9 | 13 | |
| N≡C – C≡N | 56,7 | 11,6 | 72,3 | 15.4 | 86,7 | 18,9 | 19 | |
| H – C≡C – N | 44,0 | 8,6 | 63,2 | 13,2 | 92,9 | 20,3 | 19 | |
| H 2 O | - | - | 38,4 | 7.2 | 59,7 | 12,4 | 12 | |
| CH 4 | 35,7 | 6,6 | 61,6 | 12,8 | 105,7 | 23,4 | 24 | |
| H 3 C – CH 3 | 52,5 | 10,6 | 105,6 | 23,4 | 168,7 | (*) 38,6 | 41 год | |
(*) При 3000 ° C
Удельная теплоемкость твердых тел
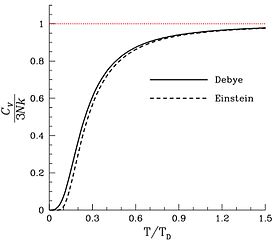
В большинстве твердых тел (но не во всех) молекулы имеют фиксированное среднее положение и ориентацию, и поэтому единственными доступными степенями свободы являются колебания атомов. Таким образом, удельная теплоемкость пропорциональна количеству атомов (не молекул) на единицу массы, что соответствует закону Дюлонга – Пети . Другой вклад может исходить от магнитных степеней свободы в твердых телах, но они редко вносят существенный вклад. и электронная. Поскольку каждый атом твердого тела вносит свой вклад в одну независимую моду колебаний, число степеней свободы в n атомах равно 6 n . Следовательно, теплоемкость образца твердого вещества ожидается равной 3 RN a или (24,94 Дж / K) N a , где N a - количество молей атомов в образце, а не молекул. Другими словами , ожидается , что атомно-молярная теплоемкость твердого вещества будет 3 R = 24,94 Дж · К -1 · моль -1 , где «амол» означает количество твердого вещества, которое содержит число атомов Авогадро.
Отсюда следует, что в молекулярных твердых телах теплоемкость на моль молекул обычно близка к 3 nR , где n - количество атомов в молекуле.
Таким образом, n атомов твердого тела в принципе должны хранить вдвое больше энергии, чем n атомов одноатомного газа. Один из способов взглянуть на этот результат - заметить, что одноатомный газ может хранить энергию только как кинетическую энергию атомов, тогда как твердое тело может хранить ее также как потенциальную энергию связей, натянутых колебаниями. Атомно-молярная теплоемкость многоатомного газа приближается к теплоемкости твердого тела по мере увеличения числа n атомов в молекуле.
Как и в случае f-газов, некоторые из мод колебаний будут «заморожены» при низких температурах, особенно в твердых телах с легкими и прочно связанными атомами, в результате чего атомно-молярная теплоемкость будет меньше этого теоретического предела. Действительно, атомно-молярная (или удельная) теплоемкость твердого вещества стремится к нулю, когда температура приближается к абсолютному нулю.
Закон Дюлонга – Пети
Как предсказано вышеупомянутым анализом, теплоемкость на моль атомов , а не на моль молекул, оказывается удивительно постоянной для всех твердых веществ при высоких температурах. Эта взаимосвязь была обнаружена эмпирически в 1819 году и названа законом Дюлонга – Пети в честь двух его первооткрывателей. Это открытие стало важным аргументом в пользу атомной теории материи.
Действительно, для твердых при комнатной температуре металлических химических элементов, атом-молярная теплоемкости в интервале от примерно 2,8 R до 3,4 R . К большим исключениям относятся твердые тела, состоящие из относительно маломассивных, прочно связанных атомов, таких как бериллий (2,0 R , только 66% от теоретического значения) и алмаз (0,735 R , только 24%). Эти условия предполагают большее расстояние между квантовыми колебательными энергиями, поэтому многие колебательные моды «замораживаются» при комнатной температуре. Водяной лед, близкий к точке плавления, также имеет аномально низкую теплоемкость на атом (1,5 R , всего 50% от теоретического значения).
На верхнем пределе возможной теплоемкости теплоемкость может незначительно превышать R из-за вкладов ангармонических колебаний в твердых телах, а иногда и умеренного вклада электронов проводимости в металлах. Это не степени свободы, рассматриваемые в теориях Эйнштейна или Дебая.
Удельная теплоемкость твердых элементов
Так как объемная плотность твердого химического элемента тесно связана с его молярной массой, существует заметная обратная корреляция между густотой твердой и ее удельной теплоемкостью на основе каждого массы. Это связано с очень приблизительной тенденцией атомов большинства элементов быть примерно одинакового размера, несмотря на гораздо более широкие вариации в плотности и атомном весе. Эти два фактора (постоянство атомного объема и постоянство удельной мольной теплоемкости) приводят к хорошей корреляции между объемом любого данного твердого химического элемента и его общей теплоемкостью.
Другими словами, удельная объемная теплоемкость ( объемная теплоемкость ) твердых элементов примерно постоянна. Мольный объем твердых элементов очень приблизительно постоянная, и (даже более надежно) , так и есть молярная теплоемкость для большинства твердых веществ. Эти два фактора определяют объемную теплоемкость, которая, как объемное свойство, может поражать своей стабильностью. Например, элемент уран - это металл, который имеет плотность почти в 36 раз больше, чем у металлического лития, но удельная теплоемкость урана на объемной основе (то есть на данный объем металла) только на 18% больше, чем у лития.
Однако средний атомный объем в твердых элементах не совсем постоянен, поэтому есть отклонения от этого принципа. Например, мышьяк , который всего на 14,5% менее плотен, чем сурьма , имеет почти на 59% большую удельную теплоемкость в пересчете на массу. Другими словами; хотя слиток мышьяка всего на 17% больше, чем слиток сурьмы той же массы, он поглощает примерно на 59% больше тепла при заданном повышении температуры. Соотношение теплоемкости двух веществ точно соответствует соотношению их молярных объемов (соотношению количества атомов в одном и том же объеме каждого вещества); отклонение от корреляции к простым объемам в этом случае происходит из-за того, что более легкие атомы мышьяка гораздо более плотно упакованы, чем атомы сурьмы, вместо того, чтобы иметь одинаковый размер. Другими словами, атомы аналогичного размера могут привести к тому, что моль мышьяка будет на 63% больше, чем моль сурьмы, с соответственно меньшей плотностью, что позволит его объему более точно отражать его поведение теплоемкости.
Влияние примесей
Иногда небольшие концентрации примесей могут сильно повлиять на удельную теплоемкость, например, в полупроводниковых ферромагнитных сплавах.
Удельная теплоемкость жидкостей
Общая теория теплоемкости жидкостей еще не создана и все еще является активной областью исследований. Долгое время считалось, что теория фононов не способна объяснить теплоемкость жидкостей, поскольку жидкости поддерживают только продольные, но не поперечные фононы, которые в твердых телах отвечают за 2/3 теплоемкости. Однако эксперименты по рассеянию Бриллюэна с нейтронами и рентгеновскими лучами , подтвердив интуицию Якова Френкеля , показали, что поперечные фононы действительно существуют в жидкостях, хотя и ограничены частотами выше порога, называемого частотой Френкеля . Поскольку большая часть энергии содержится в этих высокочастотных модах, простой модификации модели Дебая достаточно, чтобы получить хорошее приближение к экспериментальной теплоемкости простых жидкостей.
Из-за высоких энергий связи кристаллов эффекты замораживания колебательной моды наблюдаются в твердых телах чаще, чем в жидкостях: например, теплоемкость жидкой воды в два раза больше, чем у льда при примерно той же температуре, и снова близка к 3 R на моль атомов теоретического максимума Дюлонга – Пти.
Аморфные материалы можно рассматривать как тип жидкости при температурах выше температуры стеклования . Ниже температуры стеклования аморфные материалы находятся в твердом (стеклообразном) состоянии. Удельная теплоемкость имеет характерные неоднородности при температуре стеклования, которые вызваны отсутствием в стеклообразном состоянии перколяционных кластеров из разорванных связей (конфигураций), которые присутствуют только в жидкой фазе. Выше температуры стеклования просачивающиеся кластеры, образованные разорванными связями, обеспечивают более гибкую структуру и, следовательно, большую степень свободы для движения атомов, что приводит к более высокой теплоемкости жидкостей. Ниже температуры стеклования отсутствуют протяженные кластеры разорванных связей, а теплоемкость меньше, поскольку твердотельная (стекловидная) структура аморфного материала более жесткая. Неравномерность теплоемкости обычно используется для определения температуры стеклования, когда переохлажденная жидкость превращается в стекло.
Влияние водородных связей
Водородсодержащие полярные молекулы, такие как этанол , аммиак и вода , в жидкой фазе имеют мощные межмолекулярные водородные связи . Эти связи обеспечивают еще одно место, где тепло может храниться в виде потенциальной энергии вибрации даже при сравнительно низких температурах. Водородные связи объясняют тот факт, что жидкая вода хранит почти теоретический предел 3 R на моль атомов даже при относительно низких температурах (то есть около точки замерзания воды).
Смотрите также
- Квантовая статистическая механика
- Коэффициент теплоемкости
- Статистическая механика
- Термодинамические уравнения
- Термодинамические базы данных чистых веществ
- Уравнение тепла
- Коэффициент теплопередачи
- Теплота смешивания
- Скрытая теплота
- Свойства материала (термодинамика)
- Метод Джобака (Оценка теплоемкостей)
- Удельная теплота плавления (энтальпия плавления)
- Удельная теплота парообразования (энтальпия парообразования)
- Объемная теплоемкость
- Термическая масса
- R-значение (изоляция)
- Накопительный нагреватель
- Линия Френкеля