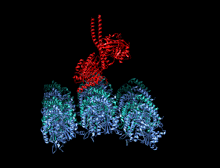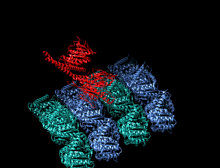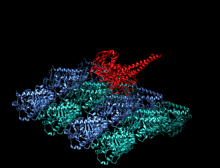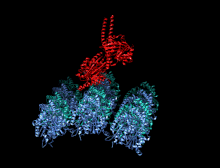Кинезин - Kinesin
Кинезин представляет собой белок , принадлежащий к классу моторных белков , обнаруженных в эукариотических клетках.
Кинезины движутся по филаментам микротрубочек (МТ) и питаются за счет гидролиза аденозинтрифосфата (АТФ) (таким образом, кинезины являются АТФазами , типом фермента). Активное движение кинезинов поддерживает несколько клеточных функций, включая митоз , мейоз и транспорт клеточного груза, например, аксональный транспорт . Большинство кинезинов движется к положительному концу микротрубочек, что в большинстве клеток влечет за собой транспортировку грузов, таких как белковые и мембранные компоненты, от центра клетки к периферии. Этот вид транспорта известен как антероградный транспорт . Напротив, динеины представляют собой моторные белки, которые движутся к минус-концу микротрубочек при ретроградном транспорте .
Открытие
Кинезины были обнаружены в 1985 году на основании их подвижности в цитоплазме, выделенной из гигантского аксона кальмара.
Оказалось, что они представляют собой двигатели антероградного внутриклеточного транспорта на основе МТ. Член-основатель этого суперсемейства, кинезин-1, был выделен в виде гетеротетрамерного двигателя быстрого транспорта аксональных органелл, состоящего из 2 идентичных моторных субъединиц (KHC) и 2 «легких цепей» (KLC), посредством аффинной очистки микротрубочек из экстрактов нервных клеток. Впоследствии из экстрактов яиц / эмбрионов иглокожих был очищен другой гетеротримерный двигатель на основе МТ, направленный на плюс-конец, названный кинезин-2, состоящий из 2 различных KHC-связанных моторных субъединиц и дополнительной субъединицы «KAP», и наиболее известен благодаря его роль в транспортировке белковых комплексов (IFT частиц) вдоль аксонем во время биогенеза ресничек . Молекулярно-генетический и геномный подходы привели к признанию того, что кинезины образуют разнообразное суперсемейство моторов, которые ответственны за множественные события внутриклеточной подвижности в эукариотических клетках. Например, геномы млекопитающих кодируют более 40 белков кинезина, организованных по меньшей мере в 14 семейств, называемых от кинезин-1 до кинезин-14.
Состав
Общая структура
Члены суперсемейства кинезинов различаются по форме, но прототипный мотор кинезина-1 состоит из двух молекул тяжелой цепи кинезина (KHC), которые образуют белковый димер (пару молекул), связывающий две легкие цепи (KLC), уникальные для разных грузов.
Тяжелая цепь кинезина-1 включает глобулярную головку (моторный домен) на аминоконцевом конце, соединенную коротким гибким шейным линкером со стеблем - длинным центральным альфа-спиральным доменом со спиральной спиралью, который заканчивается карбоксильным концом. хвостовой домен, который связан с легкими цепями. Стебли двух KHC переплетаются, образуя спиральную катушку, которая направляет димеризацию двух KHC. В большинстве случаев транспортируемый груз связывается с легкими цепями кинезина в последовательности мотива TPR KLC, но в некоторых случаях груз связывается с С-концевыми доменами тяжелых цепей.
Кинезин моторный домен
| Кинезин моторный домен | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Кинезин моторный домен | ||||||||
| Pfam | PF00225 | ||||||||
| ИнтерПро | IPR001752 | ||||||||
| УМНЫЙ | SM00129 | ||||||||
| ПРОФИЛЬ | PS50067 | ||||||||
| SCOP2 | 1bg2 / SCOPe / SUPFAM | ||||||||
| CDD | cd00106 | ||||||||
| |||||||||
Голова - это сигнатура кинезина, и ее аминокислотная последовательность хорошо сохраняется среди различных кинезинов. Каждая головка имеет два отдельных сайта связывания : один для микротрубочек, а другой для АТФ. Связывание и гидролиз АТФ, а также высвобождение АДФ изменяют конформацию связывающих микротрубочки доменов и ориентацию шейного линкера по отношению к голове; это приводит к движению кинезина. Некоторые структурные элементы в Head, включая центральный домен бета-листа и домены Switch I и II, участвуют как опосредующие взаимодействия между двумя сайтами связывания и шейным доменом. Кинезины структурно связаны с G-белками , которые гидролизуют GTP вместо ATP. Несколько структурных элементов являются общими для двух семейств, в частности, домена Switch I и Switch II.

Базовая регуляция кинезина
Кинезины, как правило, обладают низкой базальной ферментативной активностью, которая становится значительной при активации микротрубочек. Кроме того, многие члены суперсемейства кинезинов могут самоингибироваться за счет связывания хвостового домена с моторным доменом. Такое самоторможение затем можно устранить с помощью дополнительных правил, таких как привязка к грузу или грузовым адаптерам.
Грузовой транспорт
В клетке небольшие молекулы, такие как газы и глюкоза , диффундируют туда, где они необходимы. Большие молекулы, синтезируемые в теле клетки, внутриклеточные компоненты, такие как везикулы и органеллы, такие как митохондрии , слишком велики (а цитозоль слишком переполнен), чтобы иметь возможность диффундировать к месту назначения. Моторные белки выполняют роль транспортировки больших грузов по клетке к нужному месту назначения. Кинезины представляют собой моторные белки, которые транспортируют такой груз, проходя в одном направлении по дорожкам микротрубочек, гидролизуя одну молекулу аденозинтрифосфата (АТФ) на каждом этапе. Считалось, что гидролиз АТФ приводит в действие каждый шаг, и высвобождаемая энергия продвигает голову вперед к следующему участку связывания. Однако было высказано предположение, что головка диффундирует вперед, и сила связывания с микротрубочкой - это то, что тянет за собой груз. Вдобавок вирусы, например ВИЧ, используют кинезины, чтобы позволить вирусным частицам перемещаться после сборки.
Существуют убедительные доказательства того, что грузы in vivo транспортируются с помощью нескольких двигателей.
Направление движения
Моторные белки движутся в определенном направлении по микротрубочке. Микротрубочки полярны; Это означает, что головки связываются с микротрубочкой только в одной ориентации, в то время как связывание АТФ задает направление каждому шагу посредством процесса, известного как застегивание шейного линкера.
Ранее было известно, что кинезин перемещает груз к плюсовому (+) концу микротрубочки, также известный как антероградный транспорт / ортоградный транспорт. Однако недавно было обнаружено, что в почкующихся дрожжевых клетках кинезин Cin8 (член семейства Kinesin-5) также может двигаться к минус-концу или ретроградному транспорту. Это означает, что эти уникальные кинезиновые гомотетрамеры дрожжей обладают новой способностью двигаться в двух направлениях. До сих пор было показано, что кинезин движется к минус-концу только в группе, при этом двигатели скользят в антипараллельном направлении в попытке разделить микротрубочки. Эта двойная направленность наблюдалась в идентичных условиях, когда свободные молекулы Cin8 движутся к минус-концу, а поперечно-сшивающий Cin8 перемещается к плюс-концам каждой поперечно сшитой микротрубочки. Одно конкретное исследование проверило скорость, с которой двигались двигатели Cin8, их результаты показали диапазон примерно 25-55 нм / с в направлении полюсов шпинделя. На индивидуальной основе было обнаружено, что при изменении ионных условий двигатели Cin8 могут развивать скорость до 380 нм / с. Предполагается, что двунаправленность дрожжевых моторов кинезина-5, таких как Cin8 и Cut7, является результатом взаимодействия с другими моторами Cin8 и помогает выполнять роль динеина в почкующихся дрожжах, в отличие от человеческого гомолога этих моторов, плюс направил Eg5. Это открытие в белках семейства кинезина-14 (таких как Drosophila melanogaster NCD, почкующиеся дрожжи KAR3 и Arabidopsis thaliana ATK5) позволяет кинезину двигаться в противоположном направлении, к минус концу микротрубочек. Это не типично для кинезина, скорее, это исключение из нормального направления движения.
Другой тип моторного белка, известный как динеины , движется к минус-концу микротрубочки. Таким образом, они транспортируют груз от периферии ячейки к центру. Примером этого может быть транспорт, происходящий от терминальных бутонов нейронального аксона к телу клетки (соме). Это называется ретроградным транспортом .
Предлагаемые механизмы движения
Кинезин осуществляет транспорт, «идя» по микротрубочке. Было предложено два механизма для объяснения этого движения.
- В механизме «ручное управление» головки кинезина проходят одна мимо другой, чередуя ведущее положение.
- В механизме «дюймового червя» всегда ведет одна кинезиновая головка, продвигаясь вперед на шаг до того, как ведомая голова догоняет.
Несмотря на некоторые сохраняющиеся разногласия, растущее количество экспериментальных данных указывает на то, что передаточный механизм более вероятен.
Связывание и гидролиз АТФ заставляют кинезин перемещаться по «качели» вокруг точки поворота. Этот механизм качелей объясняет наблюдения, что связывание АТФ с отсутствием нуклеотидов, связанным с микротрубочкой, приводит к наклону моторного домена кинезина относительно микротрубочки. Критически важно, что до этого наклона шейный линкер не может принять свою состыкованную с моторной головкой, обращенную вперед конформацию. АТФ-индуцированный наклон дает возможность шейному линкеру стыковаться в этой обращенной вперед конформации. Эта модель основана на моделях CRYO-EM структуры кинезина, связанной с микротрубочками, которые представляют начальное и конечное состояния процесса, но не могут разрешить точные детали перехода между структурами.
Теоретическое моделирование
Предложен ряд теоретических моделей кинезина молекулярного моторного белка. Многие проблемы встречаются в теоретических исследованиях, учитывая остающуюся неопределенность в отношении роли белковых структур, точного способа преобразования энергии АТФ в механическую работу и роли тепловых флуктуаций. Это довольно активное направление исследований. Особенно необходимы подходы, которые лучше увязывают с молекулярной архитектурой белка и данными, полученными в результате экспериментальных исследований.
Динамика одиночных молекул уже хорошо описана, но кажется, что эти наномасштабные машины обычно работают в больших командах.
Динамика одной молекулы основана на различных химических состояниях двигателя и наблюдениях за его механическими действиями. При малых концентрациях аденозиндифосфата поведение двигателя определяется конкуренцией двух химико-механических мотоциклетных циклов, которые определяют тормозную силу двигателя. Третий цикл становится важным при больших концентрациях АДФ. Обсуждались также модели с одним циклом. Seiferth et al. продемонстрировали, как такие величины, как скорость или производство энтропии двигателя, изменяются, когда смежные состояния объединяются в многоциклической модели, пока в конечном итоге количество циклов не уменьшится.
Недавние экспериментальные исследования показали, что кинезины, перемещаясь по микротрубочкам, взаимодействуют друг с другом, причем взаимодействия являются короткодействующими и слабыми (1,6 ± 0,5 K B T). Одна из разработанных моделей учитывает эти взаимодействия частиц, причем динамические скорости изменяются в соответствии с энергией взаимодействия. Если энергия положительна, скорость создания связей (q) будет выше, а скорость разрыва связей (r) будет ниже. Можно понять, что скорость входа и выхода в микротрубочке также будет изменяться под действием энергии (см. Рисунок 1 в ссылке 30). Если второй сайт занят, скорость входа будет α * q, а если предпоследний сайт занят, скорость выхода будет β * r. Этот теоретический подход согласуется с результатами моделирования Монте-Карло для этой модели, особенно для предельного случая очень большой отрицательной энергии. Обычный полностью асимметричный простой процесс исключения для результатов (или TASEP) может быть восстановлен из этой модели, сделав энергию равной нулю.
Митоз
В последние годы было обнаружено, что молекулярные моторы на основе микротрубочек (включая ряд кинезинов) играют роль в митозе (делении клеток). Кинезины важны для правильной длины веретена и участвуют в раздвижении микротрубочек внутри веретена во время прометафазы и метафазы, а также в деполимеризации минус-концов микротрубочек на центросомах во время анафазы. В частности, белки семейства Kinesin-5 действуют внутри веретена, раздвигая микротрубочки, в то время как семейство Kinesin-13 действует, чтобы деполимеризовать микротрубочки.
Члены суперсемейства кинезинов
Члены суперсемейства кинезинов человека включают в себя следующие белки, которые в стандартизированной номенклатуре, разработанной сообществом исследователей кинезина, разделены на 14 семейств, называемых от кинезин-1 до кинезин-14:
- 1A - KIF1A , 1B - KIF1B , 1C - KIF1C = кинезин-3
- 2A - KIF2A , 2C - KIF2C = кинезин-13
- 3B - KIF3B или 3C - KIF3C, 3A - KIF3A = кинезин-2
- 4A - KIF4A , 4B - KIF4B = кинезин-4
- 5A - KIF5A , 5B - KIF5B , 5C - KIF5C = кинезин-1
- 6 - KIF6 = кинезин-9
- 7 - KIF7 = кинезин-4
- 9 - KIF9 = кинезин-9
- 11 - KIF11 = кинезин-5
- 12 - KIF12 = кинезин-12
- 13A - KIF13A , 13B - KIF13B = кинезин-3
- 14 - KIF14 = кинезин-3
- 15 - KIF15 = кинезин-12
- 16B - KIF16B = кинезин-3
- 17 - KIF17 = кинезин-2
- 18A - KIF18A , 18B - KIF18B = кинезин-8
- 19 - KIF19 = кинезин-8
- 20А - KIF20A , 20B - KIF20B = кинезин-6
- 21A - KIF21A , 21B - KIF21B = кинезин-4
- 22 - KIF22 = кинезин-10
- 23 - KIF23 = кинезин-6
- 24 - KIF24 = кинезин-13
- 25 - KIF25 = кинезин-14
- 26A - KIF26A , 26B - KIF26B = кинезин-11
- 27 - KIF27 = кинезин-4
- C1 - KIFC1 , C2 - KIFC2 , C3 - KIFC3 = кинезин-14
легкие цепи кинезина-1:
белок, связанный с кинезином-2:
- KIFAP3 (также известный как KAP-1, KAP3)
Смотрите также
- Аксональный транспорт
- Dynein
- Внутрилагеллярный транспорт вдоль ресничек
- Кинезин 8
- Кинезин 13
- КРП
- Молекулярный мотор
- Транспорт многомоторными белками
использованная литература
дальнейшее чтение
- Лоуренс С.Дж., Доу Р.К., Кристи К.Р., Кливленд Д.В., Доусон С.К., Эндов С.А., Голдштейн Л.С., Гудсон Х.В., Хирокава Н., Ховард Дж., Малмберг Р.Л., Макинтош-младший, Мики Х., Митчисон Т.Дж., Окада Й., Редди А.С., Сакстон В.М. , Schliwa M, Scholey JM, Vale RD, Walczak CE, Wordeman L (октябрь 2004 г.). «Стандартизированная номенклатура кинезинов» . Журнал клеточной биологии . 167 (1): 19–22. DOI : 10.1083 / jcb.200408113 . PMC 2041940 . PMID 15479732 .
внешние ссылки
- MBInfo - Кинезин транспортирует грузы по микротрубочкам
- Анимированная модель кинезин-ходьбы
- Семинар Рона Вейла: «Молекулярные моторные белки»
- Анимация движения кинезина библиотека изображений ASCB
- Мерфи, В.Ф. (2004-05-12). «Движение на основе микротрубочек» . fabric.medicalengineer.co.uk . Архивировано из оригинала на 2007-07-22 . Проверено 10 декабря 2015 .
- Внутренняя жизнь клетки, 3D-анимация с кинезином, транспортирующим везикулу
- Домашняя страница Kinesin
- Kinesin в Национальной медицинской библиотеке США по предметным рубрикам по медицине (MeSH)
- EC 3.6.4.4
- EC 3.6.4.5
- Структуры кинезина для трехмерной электронной микроскопии из EM Data Bank (EMDB)