Подход, основанный на генотипе - Genotype-first approach
Генотипа -first подход представляет собой тип стратегии используется в генетических эпидемиологических исследованиях для ассоциированных конкретных генотипов в очевидные клинические фенотипы сложного заболевания или признака. В отличие от традиционной стратегии «сначала фенотип», которая до сих пор использовалась для проведения полногеномных ассоциативных исследований (GWAS), этот подход сначала характеризует людей по статистически общему генотипу, основанному на молекулярных тестах до клинической фенотипической классификации. Этот метод группирования приводит к оценке пациентов, основанной на общей генетической этиологии наблюдаемых фенотипов, независимо от предполагаемого диагноза. Таким образом, этот подход может предотвратить исходную фенотипическую ошибку и позволить идентифицировать гены, которые вносят значительный вклад в этиологию заболевания .
На этот подход не влияет фенотипическая гетерогенность, неполная пенетрантность и уровни экспрессивности. Следовательно, он полезен при сложных заболеваниях, которые также частично совпадают, таких как расстройство аутистического спектра и умственная отсталость , что позволяет различать заболевания и определять конкретные подтипы заболевания на основе геномного содержимого.
В настоящее время подход, основанный на генотипе, используется в основном для исследовательских целей. Однако результаты этих исследований могут иметь ценные клинические применения, включая улучшение диагностики, консультирования и групп поддержки для людей с той же генетической этиологией.
Фон
Первоначально идея идентификации генотипа индивидуумов, а затем и связанного с ними фенотипа (ов) была впервые использована в ранних цитогенетических исследованиях. Примерно в 1960 году открытие трисомии 21 привело к осознанию того, что генетику можно использовать для предсказания фенотипа (ов). С 1960-х по 1990-е годы для идентификации и фенотипической характеристики пациентов с хромосомными аномалиями использовались цитогенетические методы, такие как группирование хромосом и флуоресцентная гибридизация in situ (FISH).
Сложные заболевания и признаки представляют множество трудностей для эпидемиологических исследований из-за их многофакторной природы. Более чем один ген может лежать в основе сложного заболевания и, как правило, вносит меньший эффект, чем тот, который наблюдается при моногенных заболеваниях ( менделевских заболеваниях ). Кроме того, многие из этих сложных заболеваний проявляют различные фенотипы, а также широкий диапазон выраженности и пенетрантности. Гены также могут быть плейотропными , что объясняет многие, казалось бы, различные клинические фенотипы. Эти особенности ограничивают возможность как научных, так и клинических исследований определять причинные гены или варианты наблюдаемых фенотипов и классифицировать расстройства.
Клиницисты начинают осознавать необходимость классификации геномных заболеваний по общему генотипу, а не по общему фенотипу, и то, что подход, основанный на генотипе, может принести пользу для этой цели.
Методы
При использовании подхода, основанного на генотипе, можно использовать несколько методов, однако обычно в него входят следующие шаги:
- Создание исследуемой популяции и генотипирование
- Анализ интересующих геномных вариантов, обнаруженных в исследуемой популяции
- Исследуемые популяции собираются на основе генотипа.
- Связь генотипа с фенотипом (ами) в соответствующей группе
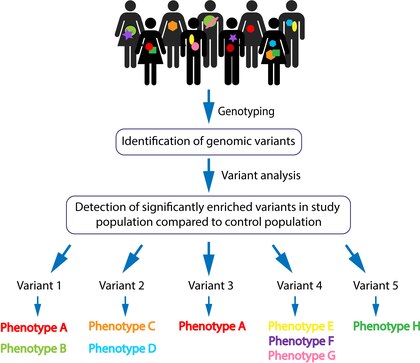
Генотипирование генерируется с использованием следующего поколения секвенирования технологий ( в том числе целого генома последовательности и секвенирование экзома ) и микрочипов анализа. Затем необработанные данные подвергаются статистическому анализу на предмет частоты появления вариантов в популяции. Общие варианты отфильтровываются, а патогенность определяется с помощью прогнозируемых генетических последствий. Эти шаги позволяют идентифицировать предполагаемые высокопенетрантные варианты и их конкретный локус . Выбранные варианты обычно повторно секвенируются для проверки (путем целевого секвенирования по Сэнгеру ). Подтвержденные геномные варианты затем могут быть проанализированы на предмет рецидивов среди пораженных индивидуумов в когорте. Патогенность геномного варианта статистически основана на его значительном обильном присутствии у пораженных по сравнению с незатронутыми людьми, а не исключительно на вредоносности варианта. Затем вариант-кандидат может быть связан с общим фенотипом с целью выявления большего числа пациентов с одним и тем же вариантом с одним и тем же фенотипом, что может привести к более сильной ассоциации. Наконец, проводится разграничение между конкретным вариантом ассоциированных клинических фенотипов [Рис. 1].
Клиническое значение и примеры
Подход, основанный на генотипе, использовался для диагностики пациентов с редкими заболеваниями, выявления новых ассоциаций генотип-фенотип заболевания и характеристики необычных или гетерогенных заболеваний на основе генотипа пациента. В 2014 г. подход «сначала генотип» использовался для оценки редких и низкочастотных вариантов в финской популяции. Поскольку финское население изолировано и недавно столкнулось с проблемой ограниченного роста населения по сравнению с другими странами, это дает два основных преимущества для исследований по первому генотипу. Вредные варианты обнаруживаются на более высоких частотах в меньшем спектре редких вариантов в популяции узких мест-основателей. При сравнении вариантов, обнаруженных с помощью секвенирования всего экзома (WES) в финской популяции, с WES из контрольной группы нефинских европейцев, варианты с потерей функции (LOF) наблюдались с большей частотой в финской популяции. Затем были проанализированы фенотипы финнов с этими вариантами LOF, чтобы установить новые ассоциации генотип-фенотип. Эти обнаруженные ассоциации включали ту, которая могла быть смертельной для эмбриона, информация, которая могла не быть обнаружена в исследованиях с использованием подхода, основанного на фенотипе. Кроме того, исследователи также обнаружили новые варианты сплайсинга в гене LPA, которые снижают уровни аполипопротеина А и предлагают защитный фенотип против сердечно-сосудистых заболеваний.
Первоначальная оценка генотипа становится стандартным подходом для клинической диагностики сложных гетерогенных заболеваний. Синдромы микродупликации и микроделеции имеют ряд характеристик, включая умственную отсталость и задержку развития , которые различаются по степени тяжести, что затрудняет диагностику пациентов с этими синдромами. С момента разработки технологий секвенирования следующего поколения клиницисты смогли использовать подход, основанный на генотипе, для группировки этих пациентов на основе их микроделеций или дупликаций и документирования признаков заболевания, присутствующих в этих группах. В частности, хромосомный микроматричный анализ используется в клинической практике для помощи в диагностике пациентов с синдромами микроделеции и микродульпликации. При таких заболеваниях, как расстройство аутистического спектра (РАС), где сложно дифференцировать пациентов на группы подтипов на основе фенотипа, исследования генотипа позволяют классифицировать пациентов на подтипы на основе их генетики. Это, в свою очередь, позволит лучше понять генетические причины РАС и в будущем может определить конкретные подтипы РАС для пациентов, которым будет поставлен диагноз.
Исследование генотипа путем выявления новых генов, связанных с заболеванием, также может принести пользу фармацевтическим компаниям и разработке лекарств. Для сложных заболеваний, использующих ассоциацию генов первого фенотипа, разработка терапевтических средств часто оказывается безуспешной из-за того, что несколько генов вносят вклад в одно заболевание. В случае ассоциаций «сначала генотип» сначала идентифицируется потенциальная терапевтическая мишень.
Преимущества и ограничения
Преимущества
- Сдвиг в сторону характеристики людей по общему генотипу, а не по клинической картине, позволит классифицировать новые синдромы и генетическую классификацию определенных подтипов заболевания, поскольку секвенирование становится дешевле, быстрее и эффективнее.
- Наследование геномного варианта от здорового родителя не привело бы к его исключению из вариантного анализа, тем самым учитывая роль модификаторов в фенотипическом результате.
- На этот подход не влияет фенотипическая неоднородность, неполная пенетрантность и экспрессивность.
- Этот подход способствует изучению как экспрессивности, плейотропии, так и спорадических мутаций.
- Этот подход исследует высокопенетрантные мутации, связанные с заболеванием, независимо от генетического фона.
- Всестороннее и подробное фенотипирование возможно даже у небольшого числа пациентов с общей генетической этиологией.
- Этот подход может выявить атипичные проявления болезни при диагностическом использовании.
Ограничения
- Фенотип может изменяться со временем (например, становится более серьезным, изменение физического местоположения), что делает исследования генотипа в первую очередь предположением о роли варианта в проявлении болезни в конкретный момент времени. Следовательно, долгосрочное наблюдение важно для того, чтобы связь генотип-фенотип со временем была оценена и был изучен прогноз заболевания.
- Выявленные варианты, которые могут способствовать мягкому фенотипу или диапазону фенотипов, не будут полезны для определения диагноза и прогноза. Однако в будущем, по мере того, как будет классифицироваться больше подтипов болезней, легкие фенотипы могут иметь большее значение.
- Связь генотип-фенотип основывается на представлении клинически распознаваемых фенотипов.
- Как видно из других исследований ассоциации генома, этот подход может генерировать варианты неизвестного значения , особенно при диагностическом использовании.
Смотрите также
- Комплексное заболевание
- Полногеномное исследование ассоциации (GWAS)
- Микрочип
- Секвенирование всего экзома (WES)
- Полногеномное секвенирование (WGS)