Контрольная точка повреждения ДНК G2-M - G2-M DNA damage checkpoint
Контрольная точка повреждения ДНК G 2 -M является важной контрольной точкой клеточного цикла у эукариотических организмов, которая гарантирует, что клетки не инициируют митоз до тех пор, пока поврежденная или не полностью реплицированная ДНК не будет в достаточной степени восстановлена. Клетки, которые имеют дефектную контрольную точку G 2 -M, если они входят в фазу M до восстановления своей ДНК, это приводит к апоптозу или гибели после деления клетки. Определяющей биохимической особенностью этой контрольной точки является активация комплексов циклин-CDK в М-фазе , которые фосфорилируют белки, которые способствуют сборке веретена и переводят клетку в метафазу .
Циклин B-CDK 1 Активность
Клеточный цикл , приводятся в движении белков , называемых циклином зависимых киназ , которые ассоциируются с циклином регуляторными белками на различных контрольных точках клеточного цикла. На разных фазах клеточного цикла происходит активация и / или дезактивация специфических комплексов циклин-CDK.
Активность CyclinB-CDK1 специфична для контрольной точки G2 / M. Накопление циклина B увеличивает активность циклинзависимой киназы Cdk1, гомолог человека Cdc2, когда клетки готовятся к митозу. Активность Cdc2 дополнительно регулируется фосфорилированием / дефосфорилированием его соответствующих активаторов и ингибиторов. Через петлю положительной обратной связи CyclinB-Cdc2 активирует фосфатазу Cdc25, которая, в свою очередь, дезактивирует ингибиторы CyclinB-Cdc2, Wee1 и Myt1. Cdc25 активирует комплекс посредством удаления фосфатов из активного центра, в то время как Wee1 инактивирует комплекс посредством фосфорилирования остатков тирозина, в частности тирозина-15.
Эта петля дополнительно усиливается косвенно через скоординированное взаимодействие киназы Aurora A и кофактора Bora. Во время фазы G2 Bora накапливается и образует комплекс активации с Aurora A. Этот комплекс затем регулирует активацию Polo-подобной киназы 1 (Plk1). Plk1 фосфорилирует Wee1, направляя его на деградацию посредством комплекса SCF ubiquitin ligase ( комплекс SCF ), и активирует Cdc25 посредством фосфорилирования с комбинированным действием, активирующим Cdc2. Комбинированная активность и комплекс Cdc2, Cdc25 и Plk1 с накоплением циклина B активирует комплекс CyclinB-Cdc2, способствуя вступлению в митоз.
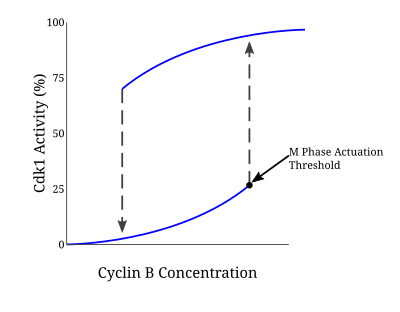
Многие белки, участвующие в этой петле положительной обратной связи, управляют активацией комплекса CyclinB-Cdc2, потому что вступление в митоз требует ответа типа «все или ничего». Модель Новака-Тайсона - это математическая модель, используемая для объяснения такой регуляторной петли, которая предсказывала необратимый переход в митоз, вызванный гистерезисом. В ходе экспериментов с бесклеточными экстрактами яиц Xenopus laevis такая модель была подтверждена как основа для вступления в митоз. Как только концентрация циклина достигает определенного минимального порога активации, Cdc2 быстро активируется. Он остается в этом состоянии до тех пор, пока активность не упадет ниже отдельного порога инактивации, при котором он резко инактивируется посредством фосфорилирования тирозина Wee1 и Myt1. В случае нереплицированной ДНК порог концентрации циклина для активации Cdc2 дополнительно увеличивается. Благодаря этому механизму существует два отдельных стационарных состояния, разделенных нестабильным стационарным состоянием. Бистабильный и гистерезисный характер CyclinB-Cdc2 обеспечивает строго регулируемый характер контрольной точки G2 / M.
Реакция пути на повреждение ДНК
Белки, которые локализуются в участках повреждения ДНК в фазе G2, инициируют сигнальный каскад, который регулирует важные компоненты пути, как описано выше, таким образом контролируя вход в митоз посредством активности CyclinB-Cdc2. Отрицательная регуляция активности CyclinB-Cdc2 приводит к задержке митотического входа, что важно для клеток для восстановления любых повреждений ДНК, которые могли накопиться после фазы S и необходимы до того, как клеточное деление может продолжиться.
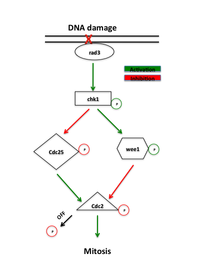
Белки, которые функционируют в контрольной точке G2-M, были первоначально идентифицированы в дрожжевых скринингах, которые искали мутанты, проявляющие повышенную чувствительность к радиации, названные мутантами «rad». Неэффективная репарация ДНК, поврежденная ионизирующим излучением или химическими агентами у этих мутантов, выявила белки, необходимые для этого пути. Ранние сигнальные белки в пути контрольной точки являются членами семейства фосфатидилинозитол-3-киназ, rad3 у дрожжей и ATR у позвоночных, которые, как полагают, локализуются в местах повреждения ДНК. Rad3 фосфорилирует rad26, который необходим для инициирования, но не для поддержания контрольной точки. Rad3 также фосфорилирует ряд других белков, отсутствие которых отменяет репарацию ДНК контрольных точек, включая rad1, rad9, hus1 и rad17. Было высказано предположение , что RAD9, hus1 и RAD17 похожи на белки , участвующих в формировании зажима , который увеличивает процессивность из ДНК - полимеразы в процессе репликации ДНК . В соответствии с этой идеей, rad17 подобен белкам, участвующим в загрузке зажима на ДНК. Это поддерживает модель, в которой фосфорилирование с помощью rad3 вызывает рекрутирование этих белков на участки повреждения ДНК, где они опосредуют активность ДНК-полимераз, участвующих в репарации ДНК .
Основным эффектором rad3 является киназа Chk1 , которая необходима для остановки G2-M в ответ на повреждающие ДНК агенты. Chk1 представляет собой эффекторную протеинкиназу, которая поддерживает митотический циклин в неактивном состоянии и фосфорилируется с помощью rad3 между S-фазой и митозом, что указывает на его специфическую роль в остановке G2. Его повышающая регуляция посредством сверхэкспрессии может вызывать арест независимо от повреждения ДНК. Кроме того, сверхэкспрессия Chk1 устраняет радиационную чувствительность мутантов rad, по-видимому, позволяя репарации ДНК происходить до вступления в митоз.
Присутствие повреждения ДНК запускает пути ATM (мутированная атаксия телеангиэктазии) или ATR (атаксия телеангиэктазии и связанные с Rad3) пути, которые активируют киназы Chk2 и Chk1 соответственно. Эти киназы действуют выше Cdc25 и Wee1, прямых регуляторов комплекса CyclinB-Cdc2. Chk1 и Chk2 фосфорилируют Cdc25, ингибируя его фосфорилирующую активность и маркируя его для убиквитинированной деградации. Эти пути также стимулируют опухолевый супрессор p53 . p53 регулирует функцию ингибитора Cdk2 p21 и белков 14-3-3, которые фосфорилируют (и тем самым инактивируют) и секвестрируют Cdc25 в цитоплазме, соответственно. Недавние исследования также подтвердили, что Cdk1 и 14-3-3 положительно регулируют Wee1 сходным образом. Гиперфосфорилирование из Wee1 от Cdk1 позволяет связывание 14-3-3, секвестрациям Wee1 к ядру и повышению ее способности фосфорилировать Cdc2. Фосфорилирование Wee1 и Cdc25 предотвращает активацию Cdc2.
Путь ATM / ATR также приводит к отрицательной регуляции Plk1, что способствует стабильности Wee1. Стабилизация Wee1 и Myt1 обеспечивает остановку клеток в G2 и делает возможным восстановление ДНК.
Множественные пути задействованы в ответе контрольной точки и, таким образом, нацеливание на Cdc25 не является единственным механизмом, лежащим в основе задержки клеточного цикла, как предлагают некоторые модели. Кооперативности между положительным регулированием Wee1 и негативной регуляцией cdc25 по Chk1 в ответ на нереплицированную или поврежденную ДНК приводит в сильном G2 аресте. Увеличение количества Wee1 и уменьшение количества Cdc25 способствует увеличению порога концентрации циклина B в петле гистерезиса, необходимого для приведения клетки к митозу.
Обслуживание контрольно-пропускного пункта
Rad3 необходим для активации Chk1 и инициации ареста G2, но полагают, что различные белки поддерживают арест G2, так что может происходить достаточная репарация ДНК. Одним из таких белков является rad18, который необходим для остановки G2, даже когда Chk1 фосфорилирован и активен. Таким образом, rad18 требуется для обслуживания контрольной точки G2 / M, в то время как Chk1 требуется для инициирования контрольной точки. Это также подтверждается его дополнительной функцией в репарации ДНК, особенно в поддержании хромосомных структур. Его необходимость демонстрируется тем фактом, что в отсутствие rad18 ДНК не может быть восстановлена, даже если задержка G2 продлевается другими способами.
Поддержание такого ареста в фазе G2 дополнительно поддерживается p53 и p21. В отсутствие p53 или p21 было продемонстрировано, что облученные клетки прогрессируют в митоз. Отсутствие p21 или 14-3-3 не может в достаточной степени ингибировать комплекс CyclinB-Cdc2, таким образом демонстрируя регуляторный контроль p53 и p21 в контрольной точке G2 в ответ на повреждение ДНК. Мутации p53 могут привести к значительному дефициту контрольных точек, что имеет важное значение для лечения рака.
Деактивация контрольной точки
Инактивация как Wee1 и cdc25 ликвидирует повреждения контрольной точки G2-M ДНК. Отсутствие Wee1 или удаление сайта тирозина-15 устраняет негативную регуляцию активности Cdc2 и заставляет клетки входить в митоз без завершения репарации, что эффективно отменяет контрольную точку G2-M. Отсутствие Cdc25 задерживает клетки в G2, но все же позволяет активировать контрольную точку G2-M, подразумевая, что как активация Wee1, так и деактивация Cdc25 являются важными регуляторными шагами в контрольной точке.
Инактивации Chk1 достаточно, чтобы преодолеть контрольную точку и способствовать вступлению в митоз, независимо от того, исправлено ли повреждение ДНК. Тем не менее, до сих пор мало что известно о точном механизме завершения контрольной точки с возможными механизмами, включая протеинфосфатазы, реверсирующие активирующее фосфорилирование, направленное расщепление активирующих белков убиквитином и антагонисты контрольных точек, способствующие митозу через независимые пути.
Рак
Было обнаружено, что многие регуляторы клеточного цикла, такие как Cdks, циклины и p53, имеют аномальную экспрессию при раке. Более конкретно, они вовлечены в переход G2 / M, локализуясь в центросоме, что, таким образом, приводит к исследованиям по манипулированию такими белками с целью повышения чувствительности рака к радиации и химиотерапии. Chk1 играет важную роль в нацеливании лекарств на рак, поскольку его функция действует в ответ на повреждение ДНК. Цитотоксические эффекты химиотерапии в настоящее время изучаются при модуляции перехода G2 / M, что касается как отмены контрольной точки, так и остановки контрольной точки. Многие методы лечения сосредоточены на инактивации контрольной точки, чтобы заставить клетки с избыточным повреждением ДНК пройти митоз и вызвать гибель клеток.