Дегалогенирование - Dehalogenation
В органической химии дегалогенирование - это набор химических реакций, которые включают разрыв связей C-галогена. Дегалогенирование бывает многих разновидностей, включая дефторирование, дехлорирование, дебромирование и деиодирование. Стимулы к исследованию дегалогенирования включают как конструктивные, так и деструктивные цели. Сложные органические соединения, такие как фармацевтические препараты, иногда образуются при дегалогенировании. Многие галогенорганические соединения опасны, поэтому их дегалогенирование является одним из путей их детоксикации.
Пути
Удаление одного атома галогена из галогенидов приводит к образованию радикалов с высокой реакционной способностью. Этот факт имеет множество последствий:
- монодегалогенирование обычно сопровождается сочетанием образующегося радикала:
- 2 RX + 2 Li → RR + 2LiX
- когда пара галогенидов взаимно смежны (вицинальные), их удаление благоприятно. Вицинальные алкилдигалогениды превращаются в алкены. Магний можно использовать:
- R 2 С (Х) С (X) R 2 + Mg → R 2 C = CR 2 + MgX 2
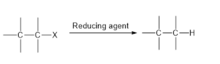
- дегалогенирование может быть осуществлено гидрогенолизом , заменой связи CX на связь CH. Катализу поддаются такие реакции:
- RX + H 2 → RH + HX
Фторид против хлорида против бромида против йодида
Скорость дегалогенирования зависит от прочности связи между углеродом и атомом галогена. Энергии диссоциации связей углерод-галоген описываются как: H 3 C-I (234 кДжмоль-1), H 3 C-Br (293 кДжмоль-1), H 3 C-Cl (351 кДжмоль-1) и H 3 CF (452 кДжмоль-1). Таким образом, для тех же структур скорость диссоциации связи для дегалогенирования будет: F <Cl <Br <I. Кроме того, скорость дегалогенирования для алкилгалогенида также зависит от стерического окружения и следует этой тенденции: первичные> вторичные> третичные галогениды.
Приложения
Поскольку хлорорганические соединения являются наиболее распространенными галогенорганическими соединениями, большинство дегалогенирований влечет за собой манипуляции со связями C-Cl.
Щелочные и щелочноземельные металлы
Металлы с высокой электроположительностью реагируют со многими органическими галогенидами при обмене металл-галоген :
- RX + 2 M → RM + MX
Полученное металлоорганическое соединение подвержено гидролизу:
- RM + H 2 O → RH + M-ОН
Тщательно изученные примеры можно найти в химии лития и магния . Далее следуют несколько иллюстративных случаев.
Литий-галогеновый обмен обеспечивает один тривиальный путь к дегалогенированию. Металлический натрий использовался в процессе дегалогенирования. Удаление атома галогена из арен-галогенидов в присутствии агента Гриньяра и воды для образования нового соединения известно как деградация Гриньяра. Дегалогенирование с использованием реактивов Гриньяра представляет собой двухэтапный процесс гидродегалогенирования. Реакция начинается с образования соединения алкил / арен-магний-галоген с последующим добавлением источника протонов с образованием дегалогенированного продукта. Егоров и его сотрудники сообщили о дегалогенировании бензилгалогенидов с использованием атомарного магния в состоянии 3P при 600 ° C. Толуол и бибензилы были получены как продукт реакции. Моррисон и его сотрудники также сообщили о дегалогенировании органических галогенидов путем мгновенного вакуумного пиролиза с использованием магния.
С комплексами переходных металлов
Многие низковалентные и богатые электронами переходные металлы вызывают стехиометрическое дегалогенирование. Реакция достигает практического интереса в контексте органического синтеза, например, сочетания Ульмана, промотированного медью .
Примеры можно найти с ванадием, хромом, марганцем, железом и кобальтом. Витамин B12 и кофермент F430 были способны последовательно дехлорировать тетрахлорэтен до этена, в то время как гематин, как было показано, дехлорировал тетрахлорэтен до винилхлорида.
Джаянт и его коллеги разработали двухфазные системы дегалогенирования трихлорэтенов. Кинетическая модель предусматривает, что процесс реакции протекает в одной фазе, а массоперенос между двумя фазами.
дальнейшее чтение
- Gotpagar, J .; Grulke, E .; Bhattacharyya, D .; Восстановительное дегалогенирование трихлорэтилена: кинетические модели и * Hetflejš, J .; Czakkoova, M .; Rericha, R .; Vcelak, J. Катализируемое дегалогенирование delor 103 гидридоалюминатом натрия. Chemosphere 2001, 44, 1521.
- Kagoshima, H .; Хашимото, Й .; Огуро, Д .; Куцуна, Т .; Сайго, К. Комбинация трофенилфосфина / хлорида германия (IV): новый агент для восстановления производных α-бромкарбоновой кислоты. Тетраэдр, 1998, 39, 1203-1206