Циклооктатетраен - Cyclooctatetraene
|
|
|||

|
|||
| Имена | |||
|---|---|---|---|
|
Предпочтительное название IUPAC
Циклоокта-1,3,5,7-тетраен |
|||
| Другие имена
[8] Аннулен
(1 Z , 3 Z , 5 Z , 7 Z ) -циклоокта-1,3,5,7-тетраен 1,3,5,7-циклооктатетраен COT |
|||
| Идентификаторы | |||
|
3D модель ( JSmol )
|
|||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard |
100.010.074 |
||
| Номер ЕС | |||
|
PubChem CID
|
|||
| UNII | |||
|
Панель управления CompTox ( EPA )
|
|||
|
|||
|
|||
| Характеристики | |||
| С 8 Н 8 | |||
| Молярная масса | 104,15 г / моль | ||
| Появление | Ясно желтый | ||
| Плотность | 0,9250 г / см 3 , жидкость | ||
| Температура плавления | От −5 до −3 ° C (от 23 до 27 ° F, от 268 до 270 K) | ||
| Точка кипения | От 142 до 143 ° C (от 288 до 289 ° F, от 415 до 416 K) | ||
| несмешиваемый | |||
| -53,9 · 10 −6 см 3 / моль | |||
| Опасности | |||
| Пиктограммы GHS |
  
|
||
| Сигнальное слово GHS | Опасность | ||
| H225 , H304 , H315 , H319 , H335 | |||
| Р210 , Р233 , Р240 , Р241 , P242 , P243 , P261 , P264 , P271 , P280 , P301 + 310 , P302 + 352 , P303 + 361 + 353 , Р304 + 340 , P305 + 351 + 338 , P312 , P321 , P331 , P332 + 313 , P337 + 313 , P362 , P370 + 378 , P403 + 233 , P403 + 235 , P405 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -11 ° С (12 ° F, 262 К) | ||
| 561 ° С (1042 ° F, 834 К) | |||
| Родственные соединения | |||
|
Связанные углеводороды
|
Циклооктан тетрафенилен |
||
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|||
|
|
|||
| Ссылки на инфобоксы | |||
1,3,5,7-циклооктатетраен ( СОТ ) является ненасыщенным производным от циклооктан , с формулой С 8 Н 8 . Он также известен как [8] аннулен . Этот полиненасыщенный углеводород представляет собой горючую жидкость от бесцветной до светло-желтого цвета при комнатной температуре. Из-за своего стехиометрического отношения к бензолу COT был предметом многих исследований и некоторых противоречий.
В отличии от бензола, С 6 Н 6 , циклооктатетраено, С 8 Н 8 , не является ароматическим , хотя его дианион , C
8ЧАС2-
8( циклооктатетраенид ), является. Его реакционная способность характерна для обычного полиена , т. Е. Он вступает в реакции присоединения . Бензол, напротив, обычно претерпевает реакции замещения , а не присоединения.
История
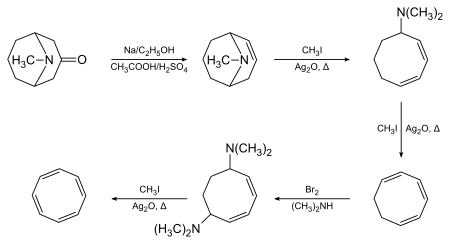
1,3,5,7-Циклооктатетраен был первоначально синтезирован Ричардом Вильштеттером в Мюнхене в 1905 году с использованием псевдопеллетерина в качестве исходного материала и исключения Гофмана в качестве ключевого преобразования:
Вильштеттер отметил, что соединение не проявляет ожидаемой ароматичности. Между 1939 и 1943 годами химики по всей территории США безуспешно пытались синтезировать СОТ. Они обосновали свое отсутствие успеха заключением, что Вильштеттер на самом деле синтезировал не соединение, а его изомер, стирол . Вильштеттер ответил на эти обзоры в своей автобиографии, где он отметил, что американские химики «не обеспокоены» восстановлением его циклооктатетраена до циклооктана (реакция, невозможная для стирола). Во время Второй мировой войны Вальтер Реппе из BASF Ludwigshafen разработал простой одностадийный синтез циклооктатетраена из ацетилена, получив материал, идентичный материалу, полученному Вильштеттером. Все оставшиеся сомнения в точности оригинального синтеза Вильштеттера были разрешены, когда Артур К. Коуп и его сотрудники из Массачусетского технологического института в 1947 году сообщили о полном повторении синтеза Вильштеттера, шаг за шагом, с использованием первоначально описанных методов. Они получили тот же циклооктатетраен и впоследствии сообщили о современных спектральных характеристиках многих промежуточных продуктов, что еще раз подтвердило точность оригинальной работы Вильштеттера.
Структура и склеивание
Ранние исследования показали, что COT не показывает химический состав ароматического соединения. Затем первые эксперименты по дифракции электронов пришли к выводу, что расстояния связи CC идентичны. Однако данные дифракции рентгеновских лучей от H. S. Kaufman продемонстрировали, что циклооктатетраен принимает несколько конформаций и содержит два различных расстояния связи C – C. Этот результат показал, что COT представляет собой аннулен с фиксированными чередующимися одинарными и двойными связями CC.
В нормальном состоянии циклооктатетраен не является плоским и принимает форму ванны с углами C = C − C = 126,1 ° и C = C − H = 117,6 °. Точечная группа циклооктатетраена - это D 2d .
В своем планарном переходном состоянии переходное состояние D 4h более стабильно, чем переходное состояние D 8h из -за эффекта Яна – Теллера .
Синтез
Оригинальный синтез Ричарда Вильштеттера (4 последовательных реакции элиминирования на циклооктановом каркасе) дает относительно низкие выходы. Синтез циклооктатетраена Реппе, который включает обработку ацетилена при высоком давлении теплой смесью цианида никеля и карбида кальция , был намного лучше, с химическим выходом около 90%:
СОТ также могут быть получены путем фотолиза из barrelene , одного из его структурных изомеров , реакции , протекающей через другой изомер, выдел емый semibullvalene . Производные COT также могут быть синтезированы посредством промежуточных соединений полубулвалена. В последовательности, проиллюстрированной ниже, октаэтилциклооктатетраен (C 8 Et 8 ) образуется термической изомеризацией октаэтилсемибулвалена, который сам образуется опосредованной бромидом меди (I) циклодимеризацией 1,2,3,4-тетраэтил-1,4-дилитио-1, 3-бутадиен.
Поскольку СОТ нестабилен и легко образует взрывоопасные органические пероксиды , к коммерчески доступному материалу обычно добавляют небольшое количество гидрохинона . Рекомендуется провести анализ на перекиси при использовании ранее открытой бутылки; белые кристаллы вокруг горлышка бутылки могут состоять из пероксида, который может взорваться при механическом воздействии.
Естественное явление
Циклооктатетраен был выделен из некоторых грибов.
Реакции
Π-связи в СОТ реагируют как обычно для олефинов, а не как ароматические кольцевые системы. Моно- и полиэпоксиды могут быть получены реакцией COT с пероксикислотами или диметилдиоксираном . Также известны различные другие реакции присоединения. Кроме того, полиацетилен можно синтезировать путем полимеризации циклооктатетраена с раскрытием цикла . Сам COT - а также аналоги с боковыми цепями - использовались в качестве лигандов металлов и в сэндвич-соединениях .
Циклооктатетраен также претерпевает реакции перегруппировки с образованием ароматических кольцевых систем. Например, окисление с водным раствором ртутью (II) , сульфата форм фенилацетальдегида и фотохимической перегруппировкой его моно- эпоксидных форм бензофурана .
Циклооктатетраенид как лиганд и предшественник лиганда

COT легко реагирует с металлическим калием с образованием соли K 2 COT, которая содержит дианион C
8ЧАС2-
8. Дианион плоский, восьмиугольный и ароматический с числом электронов Хюккеля 10.
Циклооктатетраен образует металлоорганические комплексы с некоторыми металлами, включая иттрий , лантаноиды и актиниды. Сэндвич - соединение uranocene (U (СОТ) 2 ) включает в себя два ῃ 8 -COT лиганды. В бис (циклооктатетраене) железе (Fe (COT) 2 ) один COT составляет 6, а другой 4 . (Циклооктатетраен) трикарбонил железа имеет ῃ 4 -COT. Спектры ЯМР 1 H этих комплексов железа при комнатной температуре являются синглетами, что свидетельствует о текучести .
Циклооктатетраен хлорируется с образованием [4.2.0] - бициклического соединения, которое далее реагирует с диметилацетилендикарбоксилатом в реакции Дильса-Альдера (DA). Retro-DA при 200 ° C высвобождает цис-дихлорциклобутен. Это соединение реагирует с ди-железом нонакарбонилом с образованием циклобутадиен-трикарбонила железа .
Смотрите также
- Циклобутадиен
- Пентален
- Баррелен , структурный изомер циклооктатетраена
- Гептафульвен , структурный изомер циклооктатетраена
- Семибулвален
- Бензол