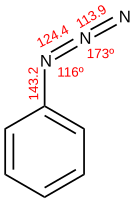Азид - Azide
Азид - это анион с формулой N-
3. Это сопр женное основание из азотистоводородной кислоты (HN 3 ). N-
3представляет собой линейный анион, изоэлектронный с CO 2 , NCO - , N 2 O , NO+
2и NCF . Согласно теории первалентной связи , азид можно описать несколькими резонансными структурами ; важное существо . Азид также является функциональной группой в органической химии , RN 3 .
Основное применение азидов в качестве пропеллента в подушках безопасности .
История
Фенилазид («диазоамидобензол») был получен в 1864 году Питером Гриссом реакцией аммиака и фенилдиазония . В 1890-х годах Теодор Курциус , открывший гидразойную кислоту (HN 3 ), описал перегруппировку ацилазидов в изоцианаты, впоследствии названную перегруппировкой Курциуса . Рольф Хьюсген описал одноименное 1,3-диполярное циклоприсоединение.
Интерес к азидам среди химиков-органиков был относительно скромным из-за сообщений о нестабильности этих соединений. Ситуация резко изменилась с открытием Sharpless et al. катализируемых Cu (3 + 2) -циклоприсоединений между органическими азидами и концевыми алкинами. Азидо- и алкиновые группы являются « биоортогональными », что означает, что они не взаимодействуют с живыми системами, и в то же время они претерпевают впечатляюще быстрое и селективное связывание. Этот тип формального 1,3-диполярного циклоприсоединения стал самым известным примером так называемой « щелочной химии » (возможно, единственным, известным неспециалисту), и область органических азидов взорвалась.
Подготовка
Неорганические азиды
Азид натрия производится в промышленности реакцией закиси азота N 2 O с амидом натрия в жидком аммиаке в качестве растворителя:
- N 2 O + 2 NaNH 2 → NaN 3 + NaOH + NH 3
Многие неорганические азиды можно получить прямо или косвенно из азида натрия. Например, азид свинца , используемый в детонаторах , может быть получен в результате реакции метатезиса между нитратом свинца и азидом натрия. Альтернативный путь - прямая реакция металла с азидом серебра, растворенным в жидком аммиаке. Некоторые азиды получают обработкой карбонатных солей азойной кислотой .
Органические азиды
Как псевдогалогенид , азид обычно замещает многие уходящие группы (например, Br - , I - , OTs - ) с образованием азидосоединения. Арилазиды могут быть получены замещением соответствующей соли диазония азидом натрия или триметилсилилазидом ; возможно также нуклеофильное ароматическое замещение , даже с хлоридами. Анилины и ароматические гидразины подвергаются диазотированию , как это делает алкил амины и гидразины.
Соответствующим образом функционализированные алифатические соединения подвергаются нуклеофильному замещению азидом натрия. Алифатические спирты дают азиды по варианту реакции Мицунобу с использованием азидов . Гидразины могут также образовывать азиды при реакции с нитритом натрия :
- PhNHNH 2 + NaNO 2 → PhN 3
Алкил- или арилацилхлориды реагируют с азидом натрия в водном растворе с образованием ацилазидов , которые дают изоцианаты в перегруппировке Курциуса .
Соединения азопереноса, трифторметансульфонилазид и имидазол-1-сульфонилазид также получают из азида натрия. Они реагируют с аминами с образованием соответствующих азидов:
- РНХ 2 → РН 3
Некоторые распространенные методы синтеза алкилазидов представлены на следующей схеме. Несомненно, предпочтительным методом остается простое нуклеофильное замещение подходящей уходящей группы на азид-анион. Уходящая группа может быть галогенидом , сульфонатом и другими. Источником азида чаще всего является азид натрия (NaN 3 ), хотя все использовались азид лития (LiN 3 ), триметилсилилазид (TMSN 3 ) и азид трибутилолова (Bu 3 SnN 3 ). Известны также микроволновые и энантиоселективные модификации реакции. Спирты можно превратить в азиды за одну стадию с использованием гексафторфосфата 2-азидо-1,3-диметилимидазолиния (ADMP) или в условиях Мицунобу с дифенилфосфорилазидом (DPPA). Гидрокси- и аминоазиды доступны при расщеплении эпоксидного и азиридинового кольца соответственно. Сообщалось о диазопереносе на амины с использованием трифторметансульфонилазида TfN 3 и тозилазида (TsN 3 ). В последние годы прямые hydroazidation из алкенов становится все более популярным.
Реакция Датта – Уормолла
Классическим методом синтеза азидов является реакция Датта-Уормолла, в которой соль диазония реагирует с сульфонамидом сначала до диазоаминосульфината, а затем при гидролизе азида и сульфиновой кислоты .
Реакции
Неорганические азиды
Соли азидов могут разлагаться с выделением газообразного азота. Температуры разложения азидов щелочных металлов: NaN 3 (275 ° C), KN 3 (355 ° C), RbN 3 (395 ° C) и CsN 3 (390 ° C). Этот метод используется для получения сверхчистых щелочных металлов.
Протонирование азидных солей дает токсичную азидную кислоту в присутствии сильных кислот:
- H + + N-
3 → HN 3
Соли азидов могут реагировать с тяжелыми металлами или соединениями тяжелых металлов с образованием соответствующих азидов, которые более чувствительны к удару, чем один азид натрия. При подкислении они разлагаются нитритом натрия. Это метод уничтожения остаточных азидов перед утилизацией.
- 2 NaN 3 + 2 HNO 2 → 3 N 2 + 2 NO + 2 NaOH
Было описано много неорганических ковалентных азидов (например, азидов хлора, брома и йода).
Азид-анион ведет себя как нуклеофил; он подвергается нуклеофильному замещению как для алифатических, так и для ароматических систем. Он вступает в реакцию с эпоксидами, вызывая разрыв кольца; он подвергается сопряженному присоединению по типу Майкла к 1,4-ненасыщенным карбонильным соединениям.
Азиды могут использоваться в качестве предшественников нитридокомплексов металлов, вызывая высвобождение N 2 , генерируя комплекс металла в необычных степенях окисления (см. Высокомалентное железо ).
Органические азиды
Органические азиды вступают в полезные органические реакции . Конечный азот умеренно нуклеофилен. Азиды легко вытесняют двухатомный азот , тенденция, которая используется во многих реакциях, таких как лигирование Штаудингера или перегруппировка Курциуса .
Азиды могут быть восстановлены до аминов путем гидрогенолиза или с помощью фосфина (например, трифенилфосфина ) в реакции Штаудингера . Эта реакция позволяет азидам выступать в качестве защищенных -NH 2 синтонов, что проиллюстрировано синтезом 1,1,1-трис (аминометил) этана :
- 3 H 2 + CH 3 C (CH 2 N 3 ) 3 → CH 3 C (CH 2 NH 2 ) 3 + 3 N 2
В азид-алкиновом циклоприсоединении Хьюисгена органические азиды реагируют как 1,3-диполи , реагируя с алкинами с образованием замещенных 1,2,3-триазолов .
Другой регулярный азид - это тозилазид в реакции с норборнадиеном в реакции внедрения азота:
Приложения
Ежегодно производится около 250 тонн азидсодержащих соединений, основным продуктом является азид натрия.
Детонаторы и порохи
Азид натрия является пропеллентом автомобильных подушек безопасности . Он разлагается при нагревании с образованием газообразного азота, который используется для быстрого расширения воздушной подушки:
- 2 NaN 3 → 2 Na + 3 N 2
Соли тяжелых металлов, такие как азид свинца , Pb (N 3 ) 2 , являются чувствительными к ударам детонаторами, которые разлагаются на соответствующий металл и азот, например:
- Pb (N 3 ) 2 → Pb + 3 N 2
Аналогично используются соли серебра и бария. Некоторые органические азиды являются потенциальным ракетным топливом, например, 2-диметиламиноэтилазид (DMAZ).
Другой
Из-за опасностей, связанных с их использованием, небольшое количество азидов используется в коммерческих целях, хотя они проявляют интересную реакционную способность для исследователей. Азиды с низким молекулярным весом считаются особенно опасными, и их следует избегать. В исследовательской лаборатории азиды являются предшественниками аминов . Они также популярны благодаря своему участию в « реакции щелчка » и в лигировании по Штаудингеру . Эти две реакции, как правило, довольно надежны и поддаются комбинаторной химии .
Некоторые азиды ценны как биоортогональные химические репортеры , молекулы, на которые можно «щелкнуть», чтобы увидеть метаболический путь, по которому они прошли внутри живой системы.
Противовирусный препарат зидовудин (AZT) содержит азидогруппу.
Азид натрия используется в качестве биоцида для предотвращения нарушений и артефактов от неконтролируемого роста микробов в лабораторных экспериментах (водные растворы, суспензии, суспензии ...).
Безопасность
- Азиды - это взрывофоры и токсины.
- Азид натрия токсичен (как цианид натрия ) (с пероральной LD 50 27 мг / кг для крыс) и может всасываться через кожу. Он взрывоопасен при нагревании до температуры выше 275 ° C и бурно реагирует с CS 2 , бромом , азотной кислотой , диметилсульфатом и рядом тяжелых металлов, включая медь и свинец . В реакции с кислотами Бренстеда выделяется высокотоксичный взрывоопасный азид водорода .
- Азиды тяжелых металлов , такие как азид свинца, являются первичными взрывчатыми веществами, способными взорваться при нагревании или встряхивании. Азиды тяжелых металлов образуются при контакте растворов азида натрия или паров HN 3 с тяжелыми металлами или их солями. Азиды тяжелых металлов могут накапливаться при определенных обстоятельствах, например, в металлических трубопроводах и на металлических компонентах различного оборудования ( роторные испарители , оборудование для сублимационной сушки , охлаждающие ловушки, водяные бани, сточные трубы) и, таким образом, приводить к сильным взрывам.
- Некоторые органические и другие ковалентные азиды классифицируются как взрывоопасные и токсичные: неорганические азиды - как нейротоксины; азид-ионы, подобно цианид- ионам, действуют как ингибиторы цитохром-с-оксидазы .
- Сообщалось, что азид натрия и связанные с полимером азидные реагенты реагируют с ди- и тригалогенметанами с образованием ди- и триазидометана, соответственно, которые оба нестабильны без обращения с растворами. Сообщалось о различных взрывах во время концентрирования реакционных смесей в роторных испарителях. Опасности диазидометана (и триазидометана) хорошо задокументированы.
- Твердые азиды галогенов очень взрывоопасны, и их не следует получать без растворителя.
Смотрите также
использованная литература
![]() В эту статью включен текст Александра Жураковского, доступный по лицензии CC BY 2.5 .
В эту статью включен текст Александра Жураковского, доступный по лицензии CC BY 2.5 .
внешние ссылки
- Синтез органических азидов , новейшие методы
- Синтез, очистка и обработка органических азидов