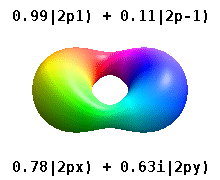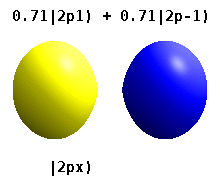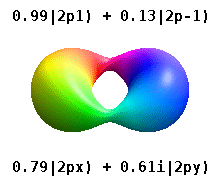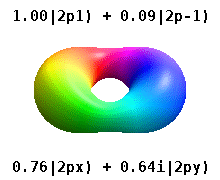Атомная орбиталь - Atomic orbital

В теории атома и квантовой механике , атомная орбиталь является математической функцией , описывающая расположение и волнообразным поведением электрона в качестве атома . Эта функция может использоваться для расчета вероятности нахождения любого электрона атома в любой конкретной области вокруг ядра атома . Термин « атомная орбиталь» может также относиться к физической области или пространству, где электрон может быть рассчитан как присутствующий, как предсказано конкретной математической формой орбитали.
Каждая орбиталь в атоме характеризуется уникальным набором значений трех квантовых чисел n , ℓ и m l , которые соответственно соответствуют энергии электрона , угловому моменту и компоненту вектора углового момента ( магнитному квантовому числу ). Каждая такая орбиталь может быть занята максимум двумя электронами, каждый со своей проекцией спина . Простые имена ев орбитали , р орбитали , d орбитали и е орбитальное относятся к орбиталей с угловым моментом квантового числа л = 0, 1, 2, и 3 соответственно. Эти имена вместе со значением n используются для описания электронных конфигураций атомов. Они получены из описания ранних спектроскопистов определенной серии щелочных металлов спектроскопических линий , как с арфой , р rincipal , д iffuse , и е undamental . Орбитали для ℓ > 3 продолжаются в алфавитном порядке, опуская j (g, h, i, k, ...), потому что некоторые языки не различают буквы «i» и «j».
Атомные орбитали являются основными строительными блоками модели атомной орбиты (также известной как модель электронного облака или волновой механики), современной структуры для визуализации субмикроскопического поведения электронов в веществе. В этой модели электронное облако многоэлектронного атома можно рассматривать как построенное (в приближении) в электронной конфигурации, которая является продуктом более простых водородоподобных атомных орбиталей. Повторяющаяся периодичность блоков из 2, 6, 10 и 14 элементов внутри разделов периодической таблицы возникает естественным образом из общего числа электронов, которые занимают полный набор s , p , d и f атомных орбиталей, соответственно, хотя для более высоких значений квантового числа n , особенно когда рассматриваемый атом несет положительный заряд, энергии определенных подоболочек становятся очень похожими, и поэтому порядок, в котором они, как говорят, населены электронами (например, Cr = [Ar ] 4s 1 3d 5 и Cr 2+ = [Ar] 3d 4 ) можно только несколько произвольно рационализировать.
Электронные свойства
С развитием квантовой механики и экспериментальных результатов (таких как дифракция электронов на двух щелях) было обнаружено, что вращающиеся электроны вокруг ядра не могут быть полностью описаны как частицы, но должны быть объяснены дуализмом волна-частица . В этом смысле электроны обладают следующими свойствами:
Волнообразные свойства:
- Электроны не вращаются вокруг ядра, как планета, вращающаяся вокруг Солнца, а вместо этого существуют как стоячие волны . Таким образом, минимально возможная энергия, которую может принять электрон, аналогична основной частоте волны на струне. Состояния с более высокой энергией подобны гармоникам этой основной частоты.
- Электроны никогда не находятся в одной точке, хотя вероятность взаимодействия с электроном в одной точке можно определить по волновой функции электрона. Заряд электрона действует так, как будто он размазан в пространстве непрерывным распределением, пропорциональным в любой точке квадрату величины волновой функции электрона .
Свойства частиц:
- Число электронов, вращающихся вокруг ядра, может быть только целым числом.
- Электроны прыгают между орбиталями, как частицы. Например, если одиночный фотон ударяет электроны, только один электрон меняет состояние в ответ на фотон.
- Электроны сохраняют свойства частиц, такие как: каждое волновое состояние имеет тот же электрический заряд, что и его электронная частица. Каждое волновое состояние имеет один дискретный спин (спин вверх или вниз) в зависимости от его суперпозиции .
Таким образом, электроны нельзя описать просто как твердые частицы. Можно провести аналогию с большой и часто причудливой «атмосферой» (электроном), распределенной вокруг относительно крошечной планеты (атомного ядра). Атомные орбитали точно описывают форму этой «атмосферы» только тогда, когда в атоме присутствует единственный электрон. Когда к одному атому добавляется больше электронов, дополнительные электроны стремятся более равномерно заполнять объем пространства вокруг ядра, так что результирующая совокупность (иногда называемая «электронным облаком атома») стремится к в целом сферической зоне вероятности, описывающей местоположение электрона из-за принципа неопределенности .
Формальное квантово-механическое определение
Атомные орбитали можно определить более точно на формальном языке квантовой механики . Они являются приближенным решением уравнения Шредингера для электронов, связанных с атомом электрическим полем ядра атома . В частности, в квантовой механике состояние атома, т. Е. Собственное состояние атомного гамильтониана , аппроксимируется разложением (см. Расширение взаимодействия конфигураций и базисный набор ) до линейных комбинаций антисимметризованных продуктов ( определителей Слейтера ) одного - электронные функции. Пространственные компоненты этих одноэлектронных функций называются атомными орбиталями. (Если учесть также их спин компонент, то говорят о атомных спиновых орбиталей .) Состояние на самом деле является функцией координат всех электронов, так что их движение коррелируют, но это часто аппроксимируется этой модели независимых частиц из произведения одноэлектронных волновых функций. ( Например, лондонская дисперсионная сила зависит от корреляции движения электронов.)
В атомной физике , то атомные спектральные линии соответствуют переходам ( квантовые скачки ) между квантовыми состояниями атома. Эти состояния обозначаются набором квантовых чисел, обозначенных термином символ и обычно связанных с конкретными электронными конфигурациями, то есть схемами заполнения атомных орбиталей (например, 1s 2 2s 2 2p 6 для основного состояния неонового символа : 1 S 0 ).
Это обозначение означает, что соответствующие детерминанты Слейтера имеют явно более высокий вес в разложении конфигурационного взаимодействия . Таким образом, концепция атомной орбиты является ключевой для визуализации процесса возбуждения, связанного с данным переходом . Например, для данного перехода можно сказать, что он соответствует возбуждению электрона с занятой орбитали на данную незанятую орбиталь. Тем не менее, следует иметь в виду, что электроны являются фермионами, управляемыми принципом запрета Паули, и их нельзя отличить друг от друга. Более того, иногда случается, что разложение конфигурационного взаимодействия очень медленно сходится, и о простой однодетерминантной волновой функции вообще нельзя говорить. Это тот случай, когда корреляция электронов велика.
По сути, атомная орбиталь - это одноэлектронная волновая функция, хотя большинство электронов не существует в одноэлектронных атомах, и поэтому одноэлектронное представление является приблизительным. Когда мы думаем об орбиталях, нам часто дают визуализацию орбиты, на которую сильно влияет приближение Хартри – Фока , которое является одним из способов уменьшить сложность теории молекулярных орбиталей .
Типы орбиталей

Атомные орбитали могут быть водородоподобными «орбиталями», которые являются точными решениями уравнения Шредингера для водородоподобного «атома» (то есть атома с одним электроном). В качестве альтернативы, атомные орбитали относятся к функциям, которые зависят от координат одного электрона (т.е. орбитали), но используются в качестве отправных точек для приближения волновых функций, которые зависят от одновременных координат всех электронов в атоме или молекуле. Системы координат, выбранные для атомных орбиталей, обычно являются сферическими координатами ( r , θ, φ) в атомах и декартовыми координатами (x, y, z) в многоатомных молекулах. Преимущество сферических координат (для атомов) состоит в том, что орбитальная волновая функция представляет собой произведение трех факторов, каждый из которых зависит от одной координаты: ψ ( r , θ, φ) = R ( r ) Θ (θ) Φ (φ) . Угловые коэффициенты атомных орбиталей Θ (θ) Φ (φ) порождает S, P, D, и т.д. , как функции вещественные комбинации из сферических гармоник Y ℓm (θ, ф) (где ℓ и м являются квантовыми числами). Обычно существуют три математические формы для радиальных функций R ( r ), которые можно выбрать в качестве отправной точки для расчета свойств атомов и молекул с большим количеством электронов:
- Водородоподобный атомные орбитали получены из точного решения уравнения Шредингера для одного электрона и ядра, для водородоподобного атома . Часть функции, которая зависит от расстояния r от ядра, имеет узлы (радиальные узлы) и убывает как e - (постоянное × расстояние) .
- Слейтер типа орбитальный (STO) представляет собой форма без радиальных узлов , но распадов от ядра , как это делает водородоподобную орбитали.
- Форма орбитали гауссовского типа (гауссианы) не имеет радиальных узлов и распадается как .
Хотя водородоподобные орбитали все еще используются в качестве педагогических инструментов, появление компьютеров сделало STO предпочтительными для атомов и двухатомных молекул, поскольку комбинации STO могут заменить узлы на водородоподобной атомной орбитали. Гауссианы обычно используются в молекулах с тремя или более атомами. Хотя сами по себе они не так точны, как STO, комбинации многих гауссиан могут достичь точности водородоподобных орбиталей.
История
Термин «орбитальная» был введен Робертом Малликеном в 1932 году как сокращение для одноэлектронной орбитальной волновой функции . Однако идея о том, что электроны могут вращаться вокруг компактного ядра с определенным угловым моментом, была убедительно аргументирована по крайней мере 19 годами ранее Нильсом Бором , а японский физик Хантаро Нагаока опубликовал основанную на орбите гипотезу электронного поведения еще в 1904 году. поведение этих электронных «орбит» было одной из движущих сил развития квантовой механики .
Ранние модели
С открытием электрона в 1897 году Дж. Дж. Томсоном стало ясно, что атомы - это не самые маленькие строительные блоки природы, а скорее составные частицы. Недавно обнаруженная структура внутри атомов заставила многих представить, как составные части атома могут взаимодействовать друг с другом. Томсон предположил, что несколько электронов вращаются по орбитальным кольцам внутри положительно заряженного желеобразного вещества, и между открытием электрона и 1909 г. эта « модель сливового пудинга » была наиболее широко распространенным объяснением атомной структуры.
Вскоре после открытия Томсона Хантаро Нагаока предсказал другую модель электронной структуры. В отличие от модели сливового пудинга, положительный заряд в «Модели Сатурна» Нагаока был сконцентрирован в центральном ядре, вытягивая электроны по круговым орбитам, напоминающим кольца Сатурна. В то время мало кто обратил внимание на работу Нагаока, и сам Нагаока признал фундаментальный недостаток теории даже при ее зачатии, а именно, что классический заряженный объект не может поддерживать орбитальное движение, потому что он ускоряется и, следовательно, теряет энергию из-за электромагнитного излучения. Тем не менее оказалось , что модель Сатурна имеет больше общего с современной теорией, чем любая из ее современников.
Атом Бора
В 1909 году Эрнест Резерфорд обнаружил, что основная масса атомной массы плотно сконденсирована в ядро, которое также оказалось положительно заряженным. Из его анализа в 1911 году стало ясно, что модель сливового пудинга не может объяснить атомную структуру. В 1913 году аспирант Резерфорда Нильс Бор предложил новую модель атома, в которой электроны вращались вокруг ядра с классическими периодами, но им разрешалось иметь только дискретные значения углового момента, квантованные в единицах h / 2π . Это ограничение автоматически допускало только определенные значения энергии электронов. Модель Бора атома решена проблема потери энергии от излучения из состояния (объявив , что не было никакого состояния ниже этого), и что более важно объяснено происхождение спектральных линий.

После того, как Бор использовал объяснение Эйнштейна фотоэлектрического эффекта для связи уровней энергии в атомах с длиной волны излучаемого света, связь между структурой электронов в атомах и спектрами излучения и поглощения атомов стала все более полезным инструментом для понимания электронов в атомах. Наиболее характерной особенностью спектров излучения и поглощения (известных экспериментально с середины XIX века) было то, что эти атомные спектры содержали дискретные линии. Значение модели Бора состояло в том, что она связала линии в спектрах излучения и поглощения с разницей в энергии между орбитами, которые электроны могут двигаться вокруг атома. Однако Бор не достиг этого путем наделения электронов какими-то волнообразными свойствами, поскольку идея о том, что электроны могут вести себя как волны материи, возникла только одиннадцатью годами позже. Тем не менее, использование в модели Бора квантованных угловых моментов и, следовательно, квантованных уровней энергии было значительным шагом на пути к пониманию электронов в атомах, а также значительным шагом в развитии квантовой механики, предполагающей, что квантованные ограничения должны учитывать все прерывистые уровни энергии. и спектры в атомах.
С предположением де Бройля о существовании волн электронной материи в 1924 году и за короткое время до полного рассмотрения водородоподобных атомов уравнением Шредингера 1926 года, можно было видеть, что "длина волны" бора-электрона является функцией его импульса. , и, таким образом, было замечено, что электрон Бора вращается по кругу, кратному его половине длины волны. В течение короткого времени модель Бора можно было рассматривать как классическую модель с дополнительным ограничением, обусловленным аргументом «длины волны». Однако этот период был немедленно вытеснен полной трехмерной волновой механикой 1926 года. В нашем нынешнем понимании физики модель Бора называется полуклассической моделью из-за ее квантования углового момента, а не в первую очередь из-за ее связи с длина волны электронов, которая появилась задним числом через десяток лет после того, как была предложена модель Бора.
Модель Бора смогла объяснить спектры излучения и поглощения водорода . Энергии электронов в состояниях n = 1, 2, 3 и т. Д. В модели Бора совпадают с энергиями современной физики. Однако это не объясняет сходства между различными атомами, как это выражено в периодической таблице, например, тот факт, что гелий (два электрона), неон (10 электронов) и аргон (18 электронов) обладают одинаковой химической инертностью. Современная квантовая механика объясняет это в терминах электронных оболочек и подоболочек, каждая из которых может содержать некоторое количество электронов, определяемое принципом исключения Паули . Таким образом, состояние n = 1 может содержать один или два электрона, в то время как состояние n = 2 может содержать до восьми электронов в подоболочках 2s и 2p. В гелии все n = 1 состояния полностью заняты; то же самое верно для n = 1 и n = 2 в неоне. В аргоне подоболочки 3s и 3p аналогичным образом полностью заняты восемью электронами; квантовая механика также допускает трехмерную подоболочку, но она имеет более высокую энергию, чем 3s и 3p в аргоне (в отличие от ситуации с атомом водорода), и остается пустой.
Современные концепции и связи с принципом неопределенности Гейзенберга
Сразу после того, как Гейзенберг открыл свой принцип неопределенности , Бор заметил, что существование любого вида волнового пакета подразумевает неопределенность в частоте и длине волны, поскольку для создания самого пакета необходим разброс частот. В квантовой механике, где все импульсы частиц связаны с волнами, именно образование такого волнового пакета локализует волну и, следовательно, частицу в пространстве. В состояниях, в которых квантово-механическая частица связана, она должна быть локализована как волновой пакет, а существование пакета и его минимальный размер подразумевает разброс и минимальное значение длины волны частицы, а, следовательно, также импульса и энергии. В квантовой механике, когда частица локализуется в меньшей области пространства, соответствующий сжатый волновой пакет требует все большего и большего диапазона импульсов и, следовательно, большей кинетической энергии. Таким образом, энергия связи для удержания или захвата частицы в меньшей области пространства неограниченно возрастает по мере того, как область пространства становится меньше. Частицы не могут быть ограничены геометрической точкой в пространстве, поскольку для этого потребуется бесконечный импульс частицы.
В области химии Шредингер , Полинг , Малликен и другие отметили, что следствием соотношения Гейзенберга было то, что электрон как волновой пакет не мог считаться имеющим точное местоположение на своей орбитали. Макс Борн предположил, что положение электрона необходимо описать распределением вероятностей, которое связано с обнаружением электрона в некоторой точке волновой функции, описывающей связанный с ним волновой пакет. Новая квантовая механика дала не точные результаты, а только вероятности появления множества возможных таких результатов. Гейзенберг считал, что путь движущейся частицы не имеет значения, если мы не можем наблюдать его, как мы не можем наблюдать электроны в атоме.
В квантовой картине Гейзенберга, Шредингера и других число атома Бора n для каждой орбитали стало известно как n-сфера в трехмерном атоме и изображалось как наиболее вероятная энергия облака вероятности волнового пакета электрона, который окружил атом.
Орбитальные имена
Орбитальные обозначения и подоболочки
Орбиталям даны имена, которые обычно даются в форме:
где X - уровень энергии, соответствующий главному квантовому числу n ; тип представляет собой символ нижнего регистра , обозначающее форму или подоболочку орбитали, соответствующий угловой момент квантового числа л .
Например, орбитальные 1s (выраженные в виде отдельных цифр и букв: «„один“ 'ESS») является самым низким уровнем энергии ( п = 1 ) и имеет угловое квантовое число л = 0 , обозначенный как с. Орбитали с ℓ = 1, 2 и 3 обозначаются как p, d и f соответственно.
Набор орбиталей для заданных n и ℓ называется подоболочкой и обозначается
- .
Показатель y показывает количество электронов в подоболочке. Например, обозначение 2p 4 означает, что подоболочка атома 2p содержит 4 электрона. Эта подоболочка имеет 3 орбитали, каждая с n = 2 и ℓ = 1.
Рентгеновское обозначение
Существует также другая, менее распространенная система, все еще используемая в рентгеновской науке, известная как рентгеновская нотация , которая является продолжением обозначений, используемых до того, как орбитальная теория была хорошо изучена. В этой системе главному квантовому числу присваивается связанная с ним буква. Для n = 1, 2, 3, 4, 5,… , буквы, связанные с этими числами, - это K, L, M, N, O, ... соответственно.
Водородоподобные орбитали
Простейшие атомные орбитали - это те, которые рассчитываются для систем с одним электроном, таких как атом водорода . Атом любого другого элемента, ионизированный до одного электрона, очень похож на водород, и орбитали принимают такую же форму. В уравнении Шредингера для этой системы один отрицательных и один положительных частиц, атомные орбитали являются собственными этим оператором Гамильтон для энергии. Их можно получить аналитически, что означает, что полученные орбитали являются произведениями полиномиального ряда, экспоненциальных и тригонометрических функций. (см. атом водорода ).
Для атомов с двумя и более электронами основные уравнения могут быть решены только с использованием методов итерационной аппроксимации. Орбитали многоэлектронных атомов качественно аналогичны орбиталям водорода, и в простейших моделях предполагается, что они имеют такую же форму. Для более строгого и точного анализа необходимо использовать численные приближения.
Заданный (водород-подобный) атомная орбиталь идентифицируются уникальными значениями трех квантовых чисел: п , л и м л . Правила, ограничивающие значения квантовых чисел и их энергии (см. Ниже), объясняют электронную конфигурацию атомов и периодическую таблицу .
Стационарные состояния ( квантовые состояния ) водородоподобных атомов являются его атомными орбиталями. Однако в целом поведение электрона не полностью описывается одной орбиталью. Электронные состояния лучше всего представлены зависящими от времени «смесями» ( линейными комбинациями ) нескольких орбиталей. См. Метод линейной комбинации атомных орбиталей и молекулярных орбиталей .
Квантовое число n впервые появилось в модели Бора, где оно определяет радиус каждой круговой электронной орбиты. Однако в современной квантовой механике n определяет среднее расстояние электрона от ядра; все электроны с одинаковым значением n находятся на одинаковом среднем расстоянии. По этой причине говорят , что орбитали с одинаковым значением n составляют « оболочку ». Орбитали с одинаковым значением n, а также с одинаковым значением ℓ связаны еще более тесно и, как говорят, составляют « подоболочку ».
Квантовые числа
Из-за квантово-механической природы электронов вокруг ядра атомные орбитали могут быть однозначно определены набором целых чисел, известных как квантовые числа. Эти квантовые числа встречаются только в определенных комбинациях значений, и их физическая интерпретация меняется в зависимости от того, используются ли реальные или сложные версии атомных орбиталей.
Сложные орбитали
В физике наиболее распространенные орбитальные описания основаны на решениях для атома водорода, где орбитали задаются произведением радиальной функции и чистой сферической гармоники. Квантовые числа вместе с правилами, определяющими их возможные значения, следующие:
Главное квантовое число n описывает энергию электрона и всегда является положительным целым числом . Фактически, это может быть любое положительное целое число, но по причинам, обсуждаемым ниже, большие числа встречаются редко. Каждый атом, как правило, имеет множество орбиталей, связанных с каждым значением n ; эти орбитали вместе иногда называют электронными оболочками .
Азимутальный квантовое число ℓ описывает орбитальный угловой момент каждого электрона и представляет собой неотрицательное целое число. В оболочке, где n - некоторое целое число n 0 , ℓ охватывает все (целые) значения, удовлетворяющие соотношению . Например, оболочка n = 1 имеет только орбитали с , а оболочка n = 2 имеет только орбитали с , и . Набор орбиталей, связанных с определенным значением ℓ , иногда вместе называют подоболочкой .
Магнитное квантовое число , описывает магнитный момент электрона в произвольном направлении, а также всегда является целым числом. В подоболочках , где есть некоторое целое число , диапазоны , таким образом: .
Вышеуказанные результаты можно обобщить в следующей таблице. Каждая ячейка представляет подоболочку и перечисляет значения, доступные в этой подоболочке. Пустые ячейки представляют собой несуществующие подоболочки.
| ℓ = 0 ( ы ) | ℓ = 1 ( р ) | ℓ = 2 ( г ) | ℓ = 3 ( е ) | ℓ = 4 ( г ) | ... | |
|---|---|---|---|---|---|---|
| п = 1 | ... | |||||
| п = 2 | 0 | -1, 0, 1 | ... | |||
| п = 3 | 0 | -1, 0, 1 | −2, −1, 0, 1, 2 | ... | ||
| п = 4 | 0 | -1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | ... | |
| п = 5 | 0 | -1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | −4, −3, −2, −1, 0, 1, 2, 3, 4 | ... |
| ... | ... | ... | ... | ... | ... | ... |
Подоболочки обычно идентифицируются по их значениям - и . обозначается числовым значением, но обозначается следующей буквой: 0 - буквой s, 1 - p, 2 - d, 3 - f и 4 - g. Например, можно говорить о подоболочке с и как «2s подоболочкой».
Каждый электрон также имеет спиновое квантовое число , S , который описывает спин каждого электрона (спин вверх или спин вниз). Число s может быть +1/2 или -1/2.
Принцип исключения Паули гласит, что никакие два электрона в атоме не могут иметь одинаковые значения всех четырех квантовых чисел. Если на орбитали находятся два электрона с заданными значениями трех квантовых чисел ( n , ℓ , m ), эти два электрона должны различаться по их спину.
Вышеупомянутые соглашения подразумевают предпочтительную ось (например, направление z в декартовых координатах), а также подразумевают предпочтительное направление вдоль этой предпочтительной оси. В противном случае не было бы смысла отличать m = +1 от m = −1 . Таким образом, модель наиболее полезна при применении к физическим системам, которые разделяют эти симметрии. Стерн-Герлах - где атом подвергается воздействию магнитного поля - обеспечивает один такой пример.
Реальные орбитали
Атом, внедренный в кристаллическое твердое тело, ощущает несколько предпочтительных осей, но часто не имеет предпочтительного направления. Вместо построения атомных орбиталей из произведения радиальных функций и одной сферической гармоники обычно используются линейные комбинации сферических гармоник, спроектированные таким образом, что мнимая часть сферических гармоник компенсируется. Эти реальные орбитали являются строительными блоками, которые чаще всего отображаются в визуализациях орбиты.
В реальных водородоподобных орбиталях, например, n и ℓ имеют ту же интерпретацию и значение, что и их сложные аналоги, но m больше не является хорошим квантовым числом (хотя его абсолютное значение есть). Орбиталям даны новые имена в зависимости от их формы по отношению к стандартизированной декартовой системе координат. Реальные водородоподобные p-орбитали даются следующими
где p 0 = R n 1 Y 1 0 , p 1 = R n 1 Y 1 1 и p −1 = R n 1 Y 1 −1 - комплексные орбитали, соответствующие ℓ = 1 .
Уравнения для орбиталей p x и p y зависят от фазового соглашения, используемого для сферических гармоник. Вышеупомянутые уравнения предполагают, что сферические гармоники определяются как . Однако некоторые квантовые физики включают в эти определения фазовый множитель (-1) m , который связывает орбиталь p x с разностью сферических гармоник и орбиталь p y с соответствующей суммой . (Подробнее см. Сферические гармоники # Условные обозначения ).
Формы орбиталей
Простые изображения, показывающие формы орбиталей, предназначены для описания угловых форм областей в космосе, где вероятно обнаружение электронов, занимающих орбиталь. Диаграммы не могут показать всю область, где можно найти электрон, поскольку согласно квантовой механике существует ненулевая вероятность найти электрон (почти) в любом месте пространства. Вместо этого диаграммы являются приблизительными изображениями граничных или контурных поверхностей, где плотность вероятности | ψ ( r , θ, φ) | 2 имеет постоянное значение, выбранное таким образом, чтобы была определенная вероятность (например, 90%) нахождения электрона внутри контура. Хотя | ψ | 2, поскольку квадрат абсолютной величины везде неотрицателен, знак волновой функции ψ ( r , θ, φ) часто указывается в каждой подобласти орбитального изображения.
Иногда функция ψ будет изображена на графике, чтобы показать ее фазы, а не | ψ ( r , θ, φ) | 2, который показывает плотность вероятности, но не имеет фаз (которые были потеряны в процессе получения абсолютного значения, поскольку ψ ( r , θ, φ) - комплексное число). | ψ ( r , θ, φ) | 2- орбитальные графы, как правило, имеют менее сферические и более тонкие лепестки, чем графы ψ ( r , θ, φ) , но имеют одинаковое количество лепестков в одних и тех же местах и в остальном узнаваемы. В этой статье, чтобы показать фазы волновой функции, в основном показаны графики ψ ( r , θ, φ) .
Лепестки можно рассматривать как интерференционные картины стоячей волны между двумя встречно вращающимися, кольцевыми резонансными бегущими волнами " m " и " - m " модами, с проекцией орбитали на плоскость xy, имеющей резонансные длины волн " m " по окружности. . Хотя это редко изображается, решения с бегущей волной можно рассматривать как вращающиеся полосчатые торы, с полосами, представляющими фазовую информацию. Для каждого м есть две стоящие волновые решения ⟨ м ⟩ + ⟨- м ⟩ и ⟨ м ⟩-⟨- м ⟩ . Для случая, когда m = 0, орбиталь вертикальная, информация о встречном вращении неизвестна, а орбиталь является симметричной по оси z . Для случая, когда ℓ = 0 , нет режимов встречного вращения. Есть только радиальные моды и форма сферически симметрична. Для любого данного п , тем меньше ℓ , тем больше радиальные узлы есть. Для любого данного л , тем меньше п , тем меньше радиальные узлы есть (ноль для зависимости от того , п первым имеет , что ℓ орбитали). Грубо говоря, n - это энергия, ℓ - это эксцентриситет , а m - ориентация. В классическом случае кольцевая резонансная бегущая волна, например, в кольцевой линии передачи, если ее активно не форсировать, спонтанно распадается на кольцевую резонансную стоячую волну, потому что со временем отражения будут нарастать даже при малейшем дефекте или неоднородности.
Вообще говоря, число n определяет размер и энергию орбитали для данного ядра: с увеличением n размер орбитали увеличивается. При сравнении различных элементов более высокий ядерный заряд Z более тяжелых элементов вызывает сокращение их орбиталей по сравнению с более легкими, так что общий размер всего атома остается примерно постоянным, даже если количество электронов в более тяжелых элементах (более высокое Z ) увеличивается.
Кроме того, в общих чертах, ℓ определяет форму орбитальной, и м л его ориентацию. Однако, поскольку некоторые орбитали описываются уравнениями в комплексных числах , форма иногда также зависит от m ℓ . Вместе весь набор орбиталей для заданных ℓ и n заполняет пространство настолько симметрично, насколько это возможно, хотя и со все более сложными наборами лепестков и узлов.
Одиночные s-орбитали ( ) имеют форму сфер. При n = 1 это примерно сплошной шар (он наиболее плотен в центре и экспоненциально затухает наружу), но при n = 2 или более каждая одиночная s-орбиталь состоит из сферически симметричных поверхностей, которые представляют собой вложенные оболочки (т. Е. «волновая структура» является радиальной, а также следует за синусоидальной радиальной составляющей). См. Изображение поперечного сечения этих вложенных оболочек справа. S-орбитали для всех n чисел - единственные орбитали с антиузлом (областью высокой плотности волновой функции) в центре ядра. Все другие орбитали (p, d, f и т. Д.) Имеют угловой момент и, таким образом, избегают ядра (имея волновой узел в ядре). Недавно была предпринята попытка экспериментального изображения 1s и 2p-орбиталей в кристалле SrTiO 3 с использованием сканирующей просвечивающей электронной микроскопии с энергодисперсионной рентгеновской спектроскопией. Поскольку визуализация проводилась с использованием электронного луча, кулоновское лучево-орбитальное взаимодействие, которое часто называют эффектом прицельного параметра, включается в окончательный результат (см. Рисунок справа).
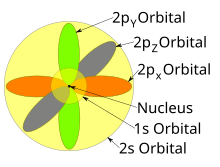
Формы p, d и f-орбиталей описаны здесь словесно и графически показаны в таблице орбиталей ниже. Три p-орбитали для n = 2 имеют форму двух эллипсоидов с точкой касания в ядре (двулопастную форму иногда называют « гантелью » - две доли направлены в противоположные стороны друг от друга. ). Эти три р-орбитали в каждой оболочке ориентированы под прямым углом друг к другу, как определено их соответствующей линейной комбинации значений м л . Общий результат - лепесток, указывающий вдоль каждого направления основных осей.
Четыре из пяти d-орбиталей для n = 3 выглядят одинаково, каждая с четырьмя грушевидными лепестками, каждая из которых касается двух других под прямым углом, а центры всех четырех лежат в одной плоскости. Три из этих плоскостей являются плоскостями xy, xz и yz - лепестки находятся между парами основных осей, а четвертая имеет центр вдоль самих осей x и y. Пятая и последняя d-орбиталь состоит из трех областей с высокой плотностью вероятности: тора между двумя грушевидными областями, расположенными симметрично относительно оси z. Всего 18 направленных лепестков указывают в каждом направлении первичной оси и между каждой парой.
Существует семь f-орбиталей, каждая из которых имеет более сложную форму, чем d-орбитали.
Кроме того, как и в случае с s-орбиталями, отдельные p, d, f и g-орбитали со значениями n выше, чем минимально возможное значение, демонстрируют дополнительную радиальную узловую структуру, которая напоминает гармонические волны того же типа по сравнению с низшая (или основная) мода волны. Как и в случае s-орбиталей, это явление обеспечивает орбитали p, d, f и g при следующем более высоком возможном значении n (например, 3p орбитали по сравнению с основными 2p), дополнительный узел в каждой доле. Еще более высокие значения n дополнительно увеличивают количество радиальных узлов для каждого типа орбиты.
Формы атомных орбиталей в одноэлектронном атоме связаны с трехмерными сферическими гармониками . Эти формы не являются уникальными, и любая линейная комбинация действует, как преобразование в кубических гармоник , на самом деле можно создавать наборы , где все двойки имеют такую же форму, как и р х , р у , и р г являются такая же форма.
Хотя отдельные орбитали чаще всего показаны независимыми друг от друга, орбитали сосуществуют вокруг ядра в одно и то же время. Кроме того, в 1927 году Альбрехт Унсельд доказал, что если суммировать электронную плотность всех орбиталей определенного азимутального квантового числа ℓ одной и той же оболочки n (например, всех трех 2p-орбиталей или всех пяти 3d-орбиталей), где каждая орбиталь занята электрон или каждый занят парой электронов, то вся угловая зависимость исчезает; то есть, в результате чего суммарная плотность всех атомных орбиталей в этой подоболочке (те , с тем же л ) имеет сферическую форму. Это известно как теорема Унзельда .
Таблица орбиталей
В этой таблице показаны все орбитальные конфигурации для реальных водородоподобных волновых функций до 7 с, и поэтому описана простая электронная конфигурация для всех элементов периодической таблицы, вплоть до радия . Графики «ψ» показаны с фазами волновой функции - и +, показанными двумя разными цветами (произвольно красным и синим). Р г орбитальное такое же , как р 0 орбитальным, а р х и р у образуются принимая линейные комбинации из р + 1 и р -1 орбиталей (именно поэтому они перечислены под т = ± 1 этикетки ). Кроме того, p +1 и p -1 не такой же формы, как p 0 , поскольку они являются чисто сферическими гармониками .
* Элементы с таким магнитным квантовым числом еще не обнаружены.
† Элементы с таким магнитным квантовым числом были обнаружены, но их электронная конфигурация является только предсказанием.
‡ электронная конфигурация элементов с помощью этого магнитного квантового числа только было подтверждено для спинового квантового числа от +1/2 .
Качественное понимание форм
Формы атомных орбиталей можно качественно понять, рассмотрев аналогичный случай стоячих волн на круглом барабане . Чтобы увидеть аналогию, необходимо учитывать среднее колебательное смещение каждого бита мембраны барабана от точки равновесия за многие циклы (мера средней скорости и импульса мембраны барабана в этой точке) относительно расстояния этой точки от центра барабана. голова. Если принять это смещение как аналогичное вероятности нахождения электрона на заданном расстоянии от ядра, то будет видно, что многие моды колеблющегося диска образуют паттерны, которые отслеживают различные формы атомных орбиталей. Основная причина этого соответствия заключается в том факте, что распределение кинетической энергии и импульса в материальной волне предсказывает, где будет находиться частица, связанная с волной. То есть вероятность нахождения электрона в данном месте также является функцией среднего импульса электрона в этой точке, поскольку высокий импульс электрона в данном положении имеет тенденцию «локализовать» электрон в этом положении через свойства электрона. волновые пакеты ( подробности механизма см. в принципе неопределенности Гейзенберга ).
Это соотношение означает, что определенные ключевые особенности могут наблюдаться как в режимах мембраны барабана, так и в атомных орбиталях. Например, во всех режимах, аналогичных s- орбиталям (верхний ряд на анимированной иллюстрации ниже), можно увидеть, что самый центр мембраны барабана вибрирует наиболее сильно, что соответствует пучности на всех s- орбиталях в атоме. . Эта пучность означает, что электрон, скорее всего, находится в физическом положении ядра (которое он проходит прямо через него, не рассеивая и не ударяя его), поскольку он движется (в среднем) наиболее быстро в этой точке, придавая ему максимальный импульс.
Мысленная картина "планетарной орбиты", наиболее близкая к поведению электронов на s- орбиталях, все из которых не имеют углового момента, может быть кеплеровской орбитой с орбитальным эксцентриситетом 1, но конечной большой осью, что физически невозможно (потому что частицы должны были столкнуться), но это можно представить как предел орбит с одинаковыми большими осями, но с возрастающим эксцентриситетом.
Ниже показан ряд режимов колебаний мембраны барабана и соответствующие волновые функции атома водорода. Можно рассмотреть соответствие, когда волновые функции вибрирующей головки барабана соответствуют двухкоординатной системе ψ ( r , θ), а волновые функции вибрирующей сферы - трехкоординатной ψ ( r , θ, φ) .
- s-образные барабанные режимы и волновые функции
Ни один из других наборов режимов в мембране барабана не имеет центральной пучности, и во всех из них центр барабана не перемещается. Они соответствуют узлу в ядре для всех не з орбиталей в атоме. Все эти орбитали имеют некоторый угловой момент, и в планетарной модели они соответствуют частицам на орбите с эксцентриситетом меньше 1.0, так что они не проходят прямо через центр первичного тела, а держатся на некотором расстоянии от него.
Кроме того, режимы барабана, аналогичные режимам p и d в атоме, демонстрируют пространственную неоднородность в различных радиальных направлениях от центра барабана, тогда как все режимы, аналогичные режимам s , совершенно симметричны в радиальном направлении. Свойства нерадиальной симметрии не- s- орбиталей необходимы для локализации частицы с угловым моментом и волновой природой на орбитали, где она должна стремиться держаться подальше от центральной силы притяжения, поскольку любая частица, локализованная в точке центрального притяжения не мог иметь момента количества движения. В этих режимах волны в пластике барабана стремятся избегать центральной точки. Такие особенности еще раз подчеркивают, что формы атомных орбиталей являются прямым следствием волновой природы электронов.
- Режимы барабана p-типа и волновые функции
- барабанные режимы d-типа
Орбитальная энергия
В атомах с одним электроном ( водородоподобные атомы ) энергия орбитали (и, следовательно, любых электронов на орбитали) определяется в основном величиной . Орбитальный имеет наименьшую возможную энергию в атоме. Каждое последовательно более высокое значение имеет более высокий уровень энергии, но разница уменьшается по мере увеличения. При высоком уровне энергии становится настолько высоким, что электрон может легко вырваться из атома. В одноэлектронных атомах все уровни с разными в пределах данного значения вырождены в приближении Шредингера и имеют одинаковую энергию. Это приближение в некоторой степени нарушается в решении уравнения Дирака (где энергия зависит от n и другого квантового числа j ), а также из-за влияния магнитного поля ядра и эффектов квантовой электродинамики . Последние вызывают крошечные различия в энергии связи, особенно для s- электронов, которые приближаются к ядру, поскольку они ощущают очень немного другой заряд ядра даже в одноэлектронных атомах; см. Лэмбовский сдвиг .
В атомах с множеством электронов энергия электрона зависит не только от внутренних свойств его орбитали, но и от его взаимодействия с другими электронами. Эти взаимодействия зависят от детализации пространственного распределения вероятностей, поэтому уровни энергии орбиталей зависят не только от, но и от . Более высокие значения связаны с более высокими значениями энергии; например, состояние 2p выше, чем состояние 2s. Когда увеличение энергии орбитали становится настолько большим, что выталкивает энергию орбитали выше энергии s-орбитали в следующей более высокой оболочке; когда энергия проталкивается в оболочку на две ступени выше. Заполнение трехмерных орбиталей не происходит до тех пор, пока не будут заполнены 4s-орбитали.
Увеличение энергии подоболочек с увеличивающимся угловым моментом в более крупных атомах связано с эффектами электрон-электронного взаимодействия и, в частности, связано со способностью электронов с низким угловым моментом более эффективно проникать в ядро, где они менее экранированы. от заряда промежуточных электронов. Таким образом, в атомах с более высоким атомным номером количество электронов становится все более и более определяющим фактором в их энергии, а основные квантовые числа электронов становятся все менее и менее важными в их энергетическом размещении.
Энергетическая последовательность первых 35 подоболочек (например, 1s, 2p, 3d и т. Д.) Приведена в следующей таблице. Каждая ячейка представляет собой подоболочку с индексами строки и столбца и задается ими соответственно. Число в ячейке - это позиция подоболочки в последовательности. Для линейного списка подоболочек с точки зрения возрастающих энергий в многоэлектронных атомах см. Раздел ниже.
|
л
п
|
s | п | d | ж | грамм | час |
|---|---|---|---|---|---|---|
| 1 | 1 | |||||
| 2 | 2 | 3 | ||||
| 3 | 4 | 5 | 7 | |||
| 4 | 6 | 8 | 10 | 13 | ||
| 5 | 9 | 11 | 14 | 17 | 21 год | |
| 6 | 12 | 15 | 18 | 22 | 26 | 31 год |
| 7 | 16 | 19 | 23 | 27 | 32 | 37 |
| 8 | 20 | 24 | 28 год | 33 | 38 | 44 год |
| 9 | 25 | 29 | 34 | 39 | 45 | 51 |
| 10 | 30 | 35 год | 40 | 46 | 52 | 59 |
Примечание: пустые ячейки указывают на несуществующие подуровни, а числа, выделенные курсивом, указывают подуровни, которые могут (потенциально) существовать, но не удерживают электроны ни в одном из известных в настоящее время элементов.
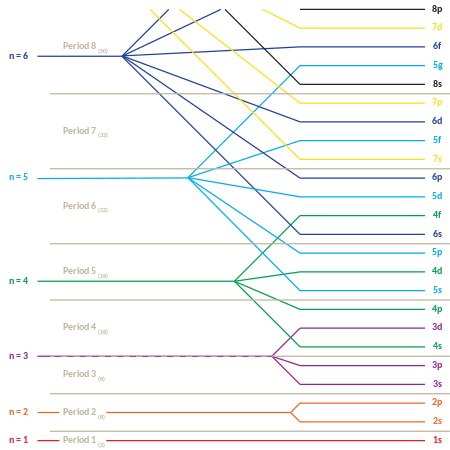
Размещение электронов и таблица Менделеева

Несколько правил регулируют размещение электронов на орбиталях ( электронная конфигурация ). Первый гласит, что никакие два электрона в атоме не могут иметь одинаковый набор значений квантовых чисел (это принцип исключения Паули ). Эти квантовые числа включают три, которые определяют орбитали, а также s или квантовое число спина . Таким образом, два электрона могут занимать одну орбиталь, если они имеют разные значения s . Однако только два электрона из-за их спина могут быть связаны с каждой орбиталью.
Кроме того, электрон всегда стремится перейти в состояние с наименьшей возможной энергией. Он может занимать любую орбиталь, если он не нарушает принцип исключения Паули, но если доступны орбитали с более низкой энергией, это состояние нестабильно. Электрон в конечном итоге потеряет энергию (выпустив фотон ) и упадет на нижнюю орбиталь. Таким образом, электроны заполняют орбитали в порядке, заданном приведенной выше энергетической последовательностью.
Такое поведение отвечает за структуру таблицы Менделеева . Таблица может быть разделена на несколько строк (называемых «точками»), пронумерованных, начиная с 1 вверху. Известные в настоящее время элементы занимают семь периодов. Если некоторый период имеет номер i , он состоит из элементов, чьи внешние электроны попадают в i- ю оболочку. Нильс Бор был первым, кто предположил (1923), что периодичность свойств элементов может быть объяснена периодическим заполнением энергетических уровней электронов, приводящим к электронной структуре атома.
Таблица Менделеева также может быть разделена на несколько пронумерованных прямоугольных « блоков ». Элементы, принадлежащие данному блоку, имеют эту общую черту: их электроны с наивысшей энергией все принадлежат одному и тому же ℓ- состоянию (но n, связанное с этим ℓ- состоянием, зависит от периода). Например, два крайних левых столбца составляют «s-блок». Внешние электроны Li и Be, соответственно, принадлежат подоболочке 2s, а электроны Na и Mg - подоболочке 3s.
Ниже приводится порядок заполнения орбиталей «подоболочки», который также дает порядок «блоков» в периодической таблице:
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
«Периодический» характер заполнения орбиталей, а также появление «блоков» s , p , d и f становится более очевидным, если этот порядок заполнения задан в матричной форме с возрастанием главных квантовых чисел, начиная с новые строки («периоды») в матрице. Затем каждая подоболочка (состоящая из первых двух квантовых чисел) повторяется столько раз, сколько требуется для каждой пары электронов, которую она может содержать. Результатом является сжатая периодическая таблица, каждая запись которой представляет два последовательных элемента:
| 1 с | |||||||||||||||
| 2 с | 2p | 2p | 2p | ||||||||||||
| 3 с | 3p | 3p | 3p | ||||||||||||
| 4 с | 3d | 3d | 3d | 3d | 3d | 4p | 4p | 4p | |||||||
| 5 с | 4d | 4d | 4d | 4d | 4d | 5p | 5p | 5p | |||||||
| 6 с | 4f | 4f | 4f | 4f | 4f | 4f | 4f | 5d | 5d | 5d | 5d | 5d | 6p | 6p | 6p |
| 7 с | 5f | 5f | 5f | 5f | 5f | 5f | 5f | 6d | 6d | 6d | 6d | 6d | 7p | 7p | 7p |
Хотя это общий порядок заполнения орбиты в соответствии с правилом Маделунга, есть исключения, и фактические электронные энергии каждого элемента также зависят от дополнительных деталей атомов (см. Электронная конфигурация # Атомы: принцип Ауфбау и правило Маделунга ).
Число электронов в электрически нейтральном атоме увеличивается с атомным номером . Электроны во внешней оболочке или валентные электроны , как правило, несут ответственность за химическое поведение элемента. Элементы, содержащие одинаковое количество валентных электронов, могут быть сгруппированы вместе и отображать аналогичные химические свойства.
Релятивистские эффекты
Для элементов с высоким атомным номером Z эффекты относительности становятся более выраженными, особенно для s-электронов, которые движутся с релятивистскими скоростями, проникая через экранирующие электроны вблизи ядра атомов с высоким Z. Это релятивистское увеличение импульса для высокоскоростных электронов вызывает соответствующее уменьшение длины волны и сокращение 6s-орбиталей по сравнению с 5d-орбиталями (по сравнению с соответствующими s- и d-электронами в более легких элементах в том же столбце периодической таблицы); это приводит к понижению энергии 6s валентных электронов.
Примеры значительных физических результатов этого эффекта включают пониженную температуру плавления ртути (которая является результатом того, что 6s-электроны недоступны для металлических связей) и золотистый цвет золота и цезия .
В модели Бора электрон с n = 1 имеет скорость, определяемую как , где Z - атомный номер, - постоянная тонкой структуры , а c - скорость света. Следовательно, в нерелятивистской квантовой механике любой атом с атомным номером больше 137 потребует, чтобы его 1s-электроны двигались быстрее скорости света. Даже в уравнении Дирака , которое учитывает релятивистские эффекты, волновая функция электрона для атомов с колебательной и неограниченной . На значение элемента 137, также известного как untriseptium , впервые указал физик Ричард Фейнман . Элемент 137 иногда неофициально называют фейнманиумом (символ Fy). Однако приближение Фейнман не может предсказать точное критическое значение Z в связи с не-точечными зарядами природы ядра и очень малым радиусом орбиты внутренних электронов, в результате чего потенциала видел внутренних электроны , которые эффективно меньше , чем Z . Критическое значение Z , которое делает атом нестабильным в отношении сильнопольного пробоя вакуума и образования электрон-позитронных пар, не возникает до тех пор, пока Z не станет примерно 173. Эти условия не наблюдаются, за исключением кратковременных столкновений очень тяжелых ядер. такие как свинец или уран в ускорителях, где, как утверждается, наблюдается такое электрон-позитронное образование в результате этих эффектов.
В релятивистских орбитальных плотностях узлов нет, хотя отдельные компоненты волновой функции будут иметь узлы.
гибридизация pp (предположительно)
Ожидается, что в элементах позднего периода-8 будет существовать гибрид 8p 3/2 и 9p 1/2 , где «3/2» и «1/2» относятся к квантовому числу полного углового момента . Этот гибрид "pp" может быть ответственным за p-блок периода из-за свойств, аналогичных p подоболочкам в обычных валентных оболочках . Уровни энергии 8p 3/2 и 9p 1/2 сближаются из-за релятивистских спин-орбитальных эффектов ; подоболочка 9s также должна участвовать, поскольку ожидается, что эти элементы будут аналогичны соответствующим элементам 5p от индия до ксенона .
Переходы между орбиталями
Связанные квантовые состояния имеют дискретные уровни энергии. Применительно к атомным орбиталям это означает, что разность энергий между состояниями также дискретна. Таким образом, переход между этими состояниями (т.е. электрон, поглощающий или испускающий фотон) может происходить только в том случае, если фотон имеет энергию, соответствующую точной разнице энергий между упомянутыми состояниями.
Рассмотрим два состояния атома водорода:
Состояние 1) n = 1 , ℓ = 0 , m ℓ = 0 и s = +1/2
Состояние 2) n = 2 , ℓ = 0 , m ℓ = 0 и s = +1/2
Согласно квантовой теории, состояние 1 имеет фиксированную энергию E 1 , а состояние 2 имеет фиксированную энергию E 2 . Итак, что произойдет, если электрон из состояния 1 перейдет в состояние 2? Чтобы это произошло, электрон должен набрать энергию точно E 2 - E 1 . Если электрон получает энергию, которая меньше или больше этого значения, он не может перейти из состояния 1 в состояние 2. Теперь предположим, что мы облучаем атом широким спектром света. Фотоны, которые достигают атома с энергией точно E 2 - E 1, будут поглощены электроном в состоянии 1, и этот электрон перейдет в состояние 2. Однако фотоны с большей или меньшей энергией не могут быть поглощены электроном. электрон, поскольку электрон может перейти только на одну из орбиталей, он не может перейти в состояние между орбиталями. В результате атом поглощает только фотоны определенной частоты. Это создает линию в спектре, известную как линия поглощения, которая соответствует разнице энергий между состояниями 1 и 2.
Таким образом, модель атомной орбиты предсказывает линейчатые спектры, которые наблюдаются экспериментально. Это одна из основных проверок модели атомной орбиты.
Тем не менее, модель атомной орбиты является приближением полной квантовой теории, которая учитывает только многие электронные состояния. Предсказания линейчатых спектров качественно полезны, но не точны количественно для атомов и ионов, кроме тех, которые содержат только один электрон.
Смотрите также
Примечания
использованная литература
- Маккоу, Чарльз С. (2015). Орбитали: с приложениями в атомных спектрах . Сингапур: Всемирная научная издательская компания. ISBN 9781783264162.
- Типлер, Пол; Ллевеллин, Ральф (2003). Современная физика (4-е изд.). Нью-Йорк: WH Freeman and Company. ISBN 978-0-7167-4345-3.
- Шерри, Эрик (2007). Периодическая таблица, ее история и ее значение . Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-530573-9.
- Левин, Ира (2014). Квантовая химия (7-е изд.). Pearson Education. ISBN 978-0-321-80345-0.
- Гриффитс, Дэвид (2000). Введение в квантовую механику (2-е изд.). Бенджамин Каммингс. ISBN 978-0-13-111892-8.
- Коэн, Ирвин; Дрофа, Томас (1966). «Атомные орбитали: ограничения и вариации». J. Chem. Educ . 43 (4): 187. Bibcode : 1966JChEd..43..187C . DOI : 10.1021 / ed043p187 .
внешние ссылки
- Трехмерные водородные орбитали на Викискладе?
- Путеводитель по атомным орбиталям
- Ковалентные связи и молекулярная структура
- Анимация временной эволюции гидрогенной орбитали
- Орбитрон , визуализация всех обычных и необычных атомных орбиталей, от 1 до 7 g.
- Большой стол Неподвижные изображения многих орбиталей