Ацетилид - Acetylide
Ацетилид относится к химическим соединениям с химическими формулами MC≡CH и MC≡CM, где M - металл. Термин используется в широком смысле и может относиться к замещенным ацетилидам, имеющим общую структуру RC≡CM (где R представляет собой органическую боковую цепь ). Ацетилиды - это реагенты в органическом синтезе . Ацетилид кальция, обычно называемый карбидом кальция, является основным коммерческим соединением.
Структура и склеивание
Ацетилиды щелочных и щелочноземельных металлов общей формулы MC≡CM представляют собой солеподобные соединения фазы Zintl , содержащие C2-
2ионы. Доказательства этого ионного характера можно увидеть в быстром гидролизе этих соединений с образованием ацетилена и оксидов металлов, есть также некоторые доказательства растворимости C2-
2ионы в жидком аммиаке. C2-
2ион имеет замкнутую оболочку основное состояние из 1 Е+
г, что делает его изоэлектронным по отношению к нейтральной молекуле N 2 , что может обеспечить ему некоторую стабильность.
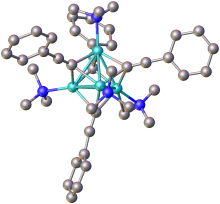
Аналогичные ацетилиды, полученные из других металлов, особенно переходных металлов , обладают ковалентным характером и неизменно связаны с их металлическими центрами. Это можно видеть в их общей устойчивости к воде (например, серебра ацетилида , меди ацетилид ) и радикально различных химических применений.
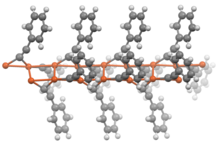
Ацетилиды общей формулы RC≡CM (где R = H или алкил) обычно проявляют свойства, аналогичные своим дважды замещенным аналогам. В отсутствие дополнительных лигандов ацетилиды металлов принимают полимерные структуры, в которых ацетилидные группы являются мостиковыми лигандами .
Подготовка
Терминальные алкины - это слабые кислоты :
- RC≡CH + R ″ M ⇌ R ″ H + RC≡CM
Для получения ацетилидов из ацетилена и алкинов необходимо использовать металлоорганические или неорганические супероснования в растворителях, которые менее кислотны, чем концевые алкины. В ранних исследованиях использовался жидкий аммиак , но чаще встречаются эфирные растворители.
Амид лития , LiHMDS или литийорганические реагенты , такие как бутиллитий , часто используются для образования ацетилидов лития:
Ацетилиды натрия или калия могут быть получены из различных неорганических реагентов (таких как амид натрия ) или из их элементарных металлов, часто при комнатной температуре и атмосферном давлении.
Ацетилид меди (I) может быть получен пропусканием ацетилена через водный раствор хлорида меди (I) из-за низкого равновесия растворимости . Аналогичным образом ацетилиды серебра могут быть получены из нитрата серебра .
Карбид кальция получают нагреванием угля с известью ( оксидом кальция ) примерно до 2000 ° C. Аналогичный процесс используется для производства карбида лития .
Реакции
Ацетилиды типа RC 2 M широко используются при алкинилировании в органической химии . Это нуклеофилы, которые добавляют к множеству электрофильных и ненасыщенных субстратов. Классическое приложение - реакция Фаворского .
Иллюстративной является последовательность, показанная ниже, этилпропиолат депротонируется н- бутиллитием с образованием соответствующего ацетилида. Этот ацетилид присоединяется к карбонильному центру циклопентанона . Гидролитическая обработка высвобождает алкиниловый спирт.
Реакции сцепления
Ацетилиды иногда являются промежуточными продуктами в реакциях сочетания . Примеры включают в себя реакцию соногаширов , Cadiot-Ходкевич муфту , Глейзер муфту и Eglinton муфту .
Опасности
Некоторые ацетилиды известны своей взрывоопасностью. Образование ацетилидов представляет опасность при работе с газообразным ацетиленом в присутствии металлов, таких как ртуть , серебро или медь , или сплавов с их высоким содержанием ( латунь , бронза , серебряный припой ).
Смотрите также
- Этинил
- Этинильный радикал
- Двухатомный углерод (нейтральный C 2 )
- Ацетилендиол

![{\ displaystyle {\ ce {{HC \! {\ Equiv} \! CH} + {\ overset {butyllithium} {BuLi}} -> [{\ ce {THF}}] [- 78 ^ {\ circ} { \ ce {C}}] {Li - \! {\ Equiv} \! - H} + BuH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae261811e4519409e7516a7a6c4576ec44871845)
